
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少量Na2S2O5,并探究SO2的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题:
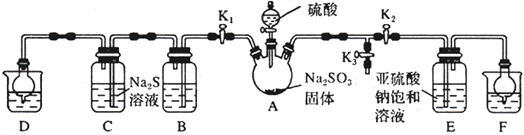
(1)向A中滴加的硫酸最好选用__________________(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是__________________________。
(3)关闭K1、K3,打开K2。一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为__________________________。
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有__________溶液;若探究SO2的还原性,B中发生反应的离子方程式可以是_____________________________________;观察到装置C 中发生的现象是__________________________。
(5)装置D和F 的作用为__________________________。
(6)设计实验验证Na2S2O5晶体在空气中已被氧化:__________________________。
(7)请指出该设计的缺陷:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
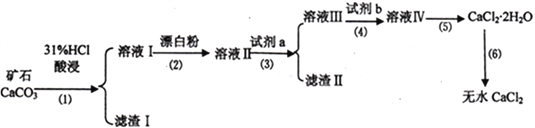
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
Al (OH)3 | Fe(OH)2 | Fe(OH)3 | |||
开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的课本实验。玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,待钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 浸有NaOH溶液的棉花球用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 在棉花球外沿滴一滴石蕊溶液,判断氯气是否被碱液完全吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】设计如图所示的装置研究电化学原理,下列叙述错误的是( )
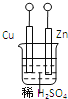
A. a、b不连接时,只锌片上有气泡逸出,锌片逐渐溶解
B. a和b用导线连接时,H+从铜片上获得锌失去的电子
C. a和b是否用导线连接,装置中所涉及的化学反应都相同
D. a和b是否用导线连接,装置中都是化学能转变为电能过程
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列变化中:①碘升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤过氧化钠溶于水 ⑥氯化铵受热分解 ⑦氧气溶于水
其中:(填序号)未发生化学键破坏的是_______;仅发生离子键破坏的是______;仅发生共价键破坏的是_______;既发生离子键破坏,又发生共价键破坏的是___________。
(2)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(Lmin)
①此时,A的浓度为__________________;
②反应开始前放入容器中B的物质的量为___________;
③B的化学反应速率为_________________________;
④x值为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000mol·L-1HCl溶液滴定10.00mL浓度为0.1000 mol·L-1Na2CO3溶液,所得滴定曲线如图所示。已知H2CO3的Ka1=10-6.4,Ka2=10-10.2,下列说法不正确的是

A. m=11.6
B. 当V=5时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. 若用酚酞作指示剂,溶液由红色变为浅红色时,消耗盐酸体积约为10mL
D. 当V=a时c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)燃料电池的工作原理如右图,有关叙述正确的是

A. 该装置能实现化学能100%转化为电能
B. 电子移动方向为:a极→b极→质子交换膜→a极
C. a电极的电极反应式为:CH3OCH3+3H2O=2CO2+12e-+12H+
D. 当b电极消耗22.4LO2时,质子交換膜有4moIH+通过
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
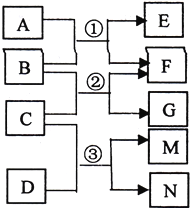
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=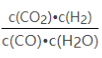 ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:

下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式: ![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
科目: 来源: 题型:
【题目】为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示 (用强酸性溶液作电解质溶液)。下列说法中不正确的是
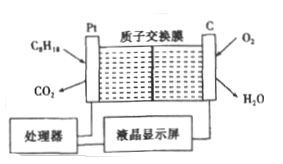
A. 石量电极作正极,电极表面有物质被还原
B. 铂电极的电极反应式为: C8H18+16H2O-50e-=8CO2+50H+
C. H+由质子交换膜左侧向右侧迁移
D. 标况下每消耗5.6 L O2电路中通过1mol 电子,经过电解质形成闭合回路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com