
科目: 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:

下列叙述中不正确的是( )
A. n=0.02 B. V=2240
C. m=3.2 D. 原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目: 来源: 题型:
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是( )
A. 标准状况下,11.2LCO2中含碳氧双键的数目为6.02×1023
B. 30gHCHO被氧化时转移电子数目为4×6.02×1023
C. 反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2+H2O
D. 理论上,吸收HCHO 与消耗Fe3+的物质的量之比为4∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-).下列说法正确的是

A. 该温度下,Ksp(BaSO4)=1.0×10-24
B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C. d点表示的是该温度下BaSO4的不饱和溶液
D. 加入BaCl2可以使溶液由c点变到a点
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
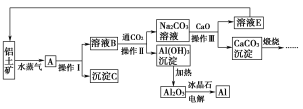
请回答下列问题:
(1)请说出沉淀C在工业上的一种用途:_____________________。
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有_____(填化学式)。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称)。实验室洗涤Al(OH)3沉淀的方法是__________________________________________。
(4)电解熔融的氧化铝,若得到标准状况下22.4 L O2,则同时生成铝的质量为________g。
(5)写出Na2CO3溶液与CaO反应的离子方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
![]()
![]()
![]()
![]()
![]()
试回答:
(1)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为________;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)________________,检验此C溶液中金属元素价态的操作方法是__________。
(2)若A、B、C为含有金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为________,X的化学式可能为(写出不同类物质)________或________,反应①的离子方程式为____________或_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是

A. 水电离出的c(H+):A点小于B点
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)=12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
科目: 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。

实验一:制备NaClO溶液(实验装置如图1所示)
(1)锥形瓶中发生反应的离子方程式是________________________________________________。
实验二:制取水合肼.(实验装置如图2所示)
已知水合肼具有还原性,被氧化生成氮气。
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(2)分液漏斗中的溶液是______(填标号).
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________________________________________________。
实验三:测定馏分中水合肼的质量分数。采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液。
b.移取25.00mL溶液于锥形瓶中,加入10mL水,摇匀。
c.用0.2000 mol·L-1的I2溶液滴定,至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右,记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为:_______________________;
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________。
(5)滴定时,碘的标准溶液盛放在___________(填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00mL,则馏分中水合肼(N2H4·H2O)的质量分数为____________________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com