
科目: 来源: 题型:
【题目】下列反应中生成H2的速率最快的是( )
金属 | 酸溶液 | 温度 | |
A | Mg | 0.5 mol·L-1 H2SO4 | 20℃ |
B | Mg | 1 mol·L-1 H2SO4 | 30℃ |
C | Zn | 2 mol·L-1 HCl | 20℃ |
D | Fe | 1 mol·L-1 HCl | 20℃ |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2是一种常见试剂,在实验室、工业生产上有广泛用途

Ⅰ.实验室用H2O2快速制氧,其分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如甲乙丙丁四图所示:
(1)下列说法正确的是:________(填字母序号)
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
(2)催化剂Mn2+在反应中,改变了____________________(填字母序号)
A.反应速率 B.反应限度C.反应焓变 D.反应路径
E.反应活化能 F.活化分子百分数
Ⅱ. H2O2在工业上作为Fenton法主要试剂,常用于处理含难降解有机物的工业废水。在调节好pH(溶液的酸碱性)和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验,并将实验结果绘制时间-p-CP浓度图如下。

(3)电中性的羟基自由基的电子式为:______________
(4)请完成以下实验设计表(表中不要留空格)。
实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | _________ | ______ | _______ | _________ |
③ | __________________ | <>298 | 10 | 6.0 | 0.30 |
(5)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:v(p-CP)=_____________
(6)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据实验结果,给出一种迅速停止反应的方法:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图甲和乙是双液原电池装置,据图判断下列说法错误的是( )
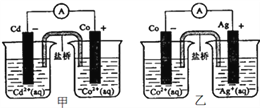
A. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
B. 甲图,电池反应的离子方程式为: Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
C. 乙图,当有1mol电子通过外电路时,正极有108gAg析出
D. 反应: 2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能够发生
查看答案和解析>>
科目: 来源: 题型:
【题目】在活性炭催化下,用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料可生成橙黄色晶体X。为测定其组成,进行如下实验。
I、氨的测定:
精确称取13.375 g X配成1000 mL溶液,取出10.00 mL溶液,注入如图所示的三颈瓶(B)中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用20.00 mL 0.20 mol·L1的标准盐酸吸收。蒸氨结束后取下接收瓶,用0.20 mol·L1NaOH标准溶液滴定过剩的HCl,到终点时消耗5.00 mLNaOH溶液。

II、氯的测定:
准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,已知:Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.12×1012。
回答下列问题:
(1)仪器a的名称是_________测定氨前应该对装置进行__________,安全管的作用原理是_____________________________________________________。
(2)NaOH标准溶液应装入___式滴定管,C装置冰盐水的作用是_________。
(3)测定氯的过程中,使用棕色滴定管的原因是____________________;判断滴定终点的方法是___________________________________________________,若终点溶液中c(Ag+)=1.0×105 mol·L1,此时c(CrO42)为______ mol·L1。
(4)13.375 g样品X中氨的物质的量为_____ mol。
(5)经测定,样品X的化学式为Co(NH3)6Cl3,写出制备X的化学方程式:_________________;X的制备过程中,若温度过高X产率下降,原因是___________________。(写一点)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,下列说法正确的是( )
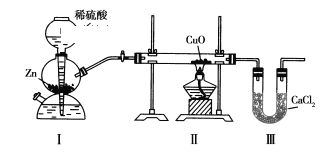
A. 若实验测得m(H):m(O)>1:8,则导致这一结果的原因可能为Ⅱ装置中的CuO没有全部被还原
B. Ⅰ、Ⅱ装置之间缺少干燥装置
C. 该实验的操作顺序为:先点燃酒精灯,然后将氢气通入Ⅱ装置
D. Ⅲ装置后是否加入干燥装置,均不会对实验结果带来影响
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中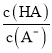 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
【答案】D
【解析】A、加水稀释时,促进铵根离子水解,所以铵根离子浓度减小的程度大,c(NH4+)/c(Cl-)的值一定减小,选项A正确;B、0.1 mol·L-1的盐酸(pH=1)和0.1 mol·L-1的弱酸HA(pH>1)溶液分别加水稀释10倍后,盐酸的pH=2,HA的pH>2,pH(HA) > pH(盐酸),选项B正确;C、根据HA![]() H++A-,Ka=
H++A-,Ka=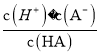 =6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中
=6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中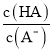 =
=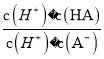 =
=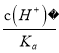 =
=![]() =0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
=0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
【题型】单选题
【结束】
24
【题目】有关锌-稀硫酸-铜构成的原电池的一些说法中,正确的是( )
A. 锌片为正极,且锌片逐渐溶解
B. 铜片为负极,且铜片上有气泡
C. 溶液中的H+移向铜极
D. 该电池工作的过程中溶液的酸性始终不变
查看答案和解析>>
科目: 来源: 题型:
【题目】I、下图是全钒液流电池的示意图

该电池充放电的总反应式为:
![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。

(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;上述过滤操作过程中所需用到的玻璃仪器有__________________________________。
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
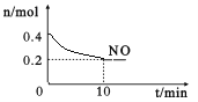
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
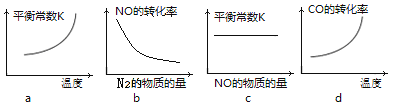
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com