
科目: 来源: 题型:
【题目】通常状况下,下列物质中①硫酸钡 ②醋酸 ③氯化氢 ④三氧化硫 ⑤氯气 ⑥碳酸钠 ⑦铜 ⑧硫酸溶液 ⑨氢氧化钾 ⑩乙醇(下列各空填序号)
(1)属于强电解质的是:________________。
(2)属于弱电解质的是:________________。
(3)能导电的是:________________。
(4)属于非电解质的是:________________。
(5)碳酸钠溶液显碱性的原因________(用离子方程式表达)。
查看答案和解析>>
科目: 来源: 题型:
【题目】四元轴烯(a)、苯乙烯(b)\、立方烷(c)的分子式均为C8H8,下列说法正确的是
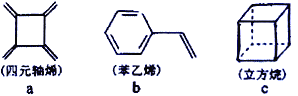
A. a 的同分异构体只有b 和c两种
B. a、b、c均能使溴的四氯化碳溶液褪色
C. a、b分子中的所有原子一定处于同一平面
D. a、c的二氯代物有3种,b的一氯代物有5 种(不考虑立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】用乙烯和乙醇为原料制取草酸二乙酯的过程中发生的反应类型及顺序正确的是
①酯化反应 ②氧化反应 ③水解反应 ④加成反应
A. ②④③① B. ④①②③ C. ④③②① D. ②③①④
查看答案和解析>>
科目: 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq)![]() I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
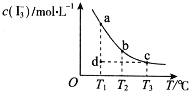
A. 反应 I2(aq)+I﹣(aq)![]() I3﹣(aq)△H>0
I3﹣(aq)△H>0
B. 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1
C. 若T1时,反应进行到状态d时,一定有υ正>υ逆
D. 状态a与状态b相比,状态b时I2的转化率更高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质进行一氯取代后,生成的产物只有2种的是
A.(CH3)2CHCH(CH3)2
B.(CH3)3CCH2CH3
C.(CH3CH2)2CHCH3
D.(CH3)4C
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,某容积恒定的密闭容器中发生如下可逆反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
H2(g)+CO2(g) △H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
A. 升高温度 B. 再加入2n mol H2
C. 再加入n mol CO和n mol H2O D. 再加入2n mol CO2和2n mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】一种第二代抗组胺药物的中间体G的合成路线如下:
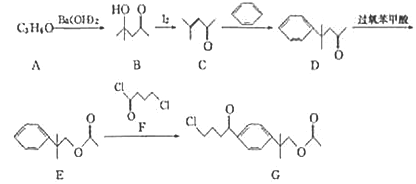
已知:A的分子结构中含有2个甲基。
回答下列问题:
(1)A的名称为__________,由A生成B的反应类型为_______。
(2)G中含氧官能团名称为_______。
(3)F的分子式为_______。
(4)由C生成D的化学方程式为______________。
(5)对二取代芳香化合物W是E的同分异构体,W能发生银镜反应和水解反应,水解产物之一能与FeCl3溶液发生显色反应,则W有________种结构,其中核磁共振氢谱为五组峰,且峰面积之比为1:2 : 2 : 2:9的结构简式为_____________。
(6)参照上述合成路线,以乙醛为原料(无机试剂任选),设计正丁醇的合成路线:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
A. 新平衡体系中,SO2和O2物质的量之比仍为2∶1
B. 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小
C. 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大
D. 若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。

①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com