
科目: 来源: 题型:
【题目】某饱和一元醛发生银镜反应时可析出21.6克银,等量的此醛完全燃烧可生成8.96升CO2(标准状况),则该醛是
A. 乙醛 B. 2—甲基丁醛 C. 丁醛 D. 己醛
查看答案和解析>>
科目: 来源: 题型:
【题目】大脑的生长发育与不饱和脂肪酸密切相关,深海鱼油中提取的“DHA”就是一种不饱和程度很高的脂肪酸,称为“脑黄金”,它的分子中含有6个碳碳双键,名称为二十六碳六烯酸,其化学式为
A. C25H50COOH B. C26H41COOH C. C25H39COOH D. C26H47COOH
查看答案和解析>>
科目: 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________, 含有离子键、____________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__________(填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
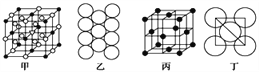
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为________(用字母表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________(中和热数值为57.3kJ/mol)。
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是__________________________。
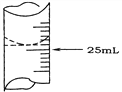
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为___________。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是_________________________________________________。
【答案】 H+(aq)+OH-(aq)= H2O(l)△H=-57.3kJ·mol-1 B 用碱液润洗 23.80mL 0.1044 mol·L-1 BD 滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不复原
【解析】 I.(1).强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,则稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ·mol-1;故答案为:H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ·mol-1;
(2).A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,则残留在温度计上的NaOH会与盐酸反应,使盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故A正确;B.量取盐酸的体积时仰视读数,会导致所量取的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故B错误;C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,中和热的数值偏小,故C正确;D.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故D正确;因此答案选B
II. (1)碱式滴定管用蒸馏水洗净后,接下来应该用待测的NaOH溶液进行润洗,否则会将NaOH溶液稀释,造成实验误差,故答案为:用碱液润洗;
(2).由图可知,滴定后液面的读数为:24.90mL,因滴定前滴定管内液面读数为1.10 mL,则此时消耗标准溶液的体积为:(24.90-1.10)mL=23.80mL,故答案为:23.80mL;
(3).由表中数据可知,第1次消耗标准液的体积是:(26.11-0.00)mL=26.11mL,第2次消耗标准液的体积是:(33.30-1.56)mL=31.74mL,第3次消耗标准液的体积是:(26.31-0.22)mL=26.09mL,因第2次数据误差较大,故舍去,则消耗标准液的平均体积是:(26.11+26.09)mL÷2=26.10mL,所以NaOH溶液的物质的量浓度为:c(NaOH)=![]() = 0.1044 mol·L-1,故答案为:0.1044 mol·L-1;
= 0.1044 mol·L-1,故答案为:0.1044 mol·L-1;
(4). A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定,对实验结果无影响,故A错误;B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,则消耗标准液体积偏大,测定结果偏高,故B正确;C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定,则所取待测液偏少,消耗标准液的体积偏少,测定结果偏低,故C错误;D.滴定前俯视滴定管读数,滴定后平视滴定管读数,则导致所量取的标准液体积偏大,测定结果偏高,故D正确;答案选BD;
(5). 到滴定终点时,当滴入最后一滴标准液,溶液会由红色变为无色,且半分钟内不复原,故答案为:滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不复原。
【题型】实验题
【结束】
26
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 64.0 | 50.7 | 42.9 |
请回答下列问题:
①该反应的平衡常数表达式K=__________,ΔH_______0(填“>”、“<”或“=”)。
②欲提高反应中CO的平衡转化率,可采取的措施是_____________________。
A.减少Fe的量 B.加入合适的催化剂
C.增大容器的体积 D.降低反应的温度
③在一个容积为1 L的密闭容器中,1000 ℃时加入Fe2O3、CO各2 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=______________,Fe2O3的平衡转化率为________。
(2)饱和Mg(OH)2溶液中滴加FeCl3溶液,产生红褐色沉淀, 反应的离子方程式是________________________________________。
(3)已知:2Fe(s)+3/2O2(g)=Fe2O3(s) △H=824 kJ·mol-1、2Al(s)+3/2O2(g)=Al2O3(s) △H=1675.7 kJ·mol-1。则铝与Fe2O3发生反应生成Al2O3和Fe的热化学方程式为 :___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
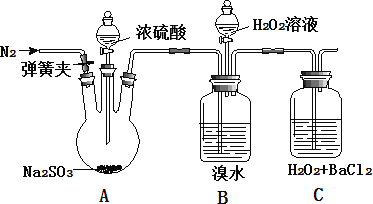
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探索工业中铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:
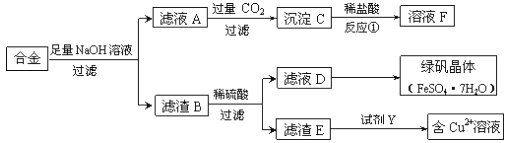
(1)操作①的名称是______________,滤渣B含有_______________(填化学式)。
(2)反应①的离子方程式是_________________________________。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作是______________、冷却结晶、过滤、自然干燥,这一系列操作中没有用到的仪器有________(填序号)。
A.漏斗 B.坩埚 C.烧杯 D.玻璃棒
(4)试剂Y应该是一种________(填“氧化剂”或“还原剂”),它不可能是____(填序号)。
A.过氧化氢 B.氢气 C.氧气 D.铁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.由分子组成的物质都含有共价键
B.C(石墨,s) =C(金刚石,s),反应中既没有电子的得失也没有能量的变化
C.干冰升华时,二氧化碳分子中的共价键不发生断裂
D.伴有能量变化的物质变化,都是化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=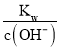 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有a.BaCl2 b.金刚石 c.NH4Cl d.Na2SO4 e.干冰 f.碘片六种物质,按下列要求回答(若有多个选项的,多选错选不给分):
①熔化时需要破坏共价键的是______, 熔点最高的是_______,熔点最低的是_______。
②属于离子化合物的是________,只含有离子键的物质是________,含有两种化学键的物质是_________,含有分子间作用力的是__________。
(2)看下图回答下列问题
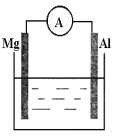
①若烧杯中溶液为稀硫酸,则观察到的现象是___________,负极反应式为___________。
②若烧杯中溶液为氢氧化钠溶液,则负极为_______(填Mg或Al),总反应方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com