
科目: 来源: 题型:
【题目】(1)己知 Na2CO3 溶液中存在水解平衡:CO32﹣+H2O![]() HCO3﹣+OH﹣,请用 Na2CO3 溶液及必要的试剂仪器,设计简单实验,证明盐类的水解是一个吸热过程.操作是_________,现象是___________。
HCO3﹣+OH﹣,请用 Na2CO3 溶液及必要的试剂仪器,设计简单实验,证明盐类的水解是一个吸热过程.操作是_________,现象是___________。
(2)已知等浓度的醋酸和醋酸钠溶液等体积混合呈酸性是因为醋酸的电离常数______醋酸钠的水解常数(选填“大于”、“小于”或“等于”);可知该温度下醋酸钠(或醋酸根)的水解常数_____1.0×10-7 (选填“大于”、“小于”或“等于”)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
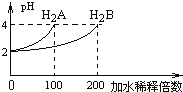
A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
科目: 来源: 题型:
【题目】保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
A.Na2CO3溶液的碱性增强
B.阳极反应:CO32--2e-+H2O = CO2↑+2OH-
C.溶液中CO32-+H2O ![]() HCO3-+OH-平衡不移动
HCO3-+OH-平衡不移动
D.向溶液中加入一定量HCOOH的能复原
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.含有大量Ba2+的溶液:Cl﹣ K+ SO42﹣ CO32﹣
B.含有大量H+的溶液:Mg2+ Na+ SO42﹣ CO32﹣
C.含有大量 OH﹣的溶液:Cu2+ NO3﹣ SO42﹣ CO32﹣
D.含有大量Na+的溶液:H+ K+ SO42﹣ NO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
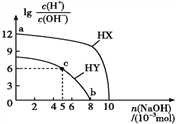
A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY)
C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家合成了一种新型除草剂的合成路线如下:

(1)① 中两种含氧官能团的名称_______、_____。除草剂⑦的分子式为_______ 。
(2)③与⑥生成⑦的反应类型是____,④⑤转化中另外一种产物是HCl,则试剂X是_____ 。
(3)写出一种同时满足下列条件的物质③的同分异构体的结构简式______________。
① 属于芳香族化合物; ② 苯环上的一取代物只有两种;
③ 在铜催化下与O2反应,其生成物1 mol与足量的银氨溶液反应生成4 mol Ag
(4)写出②③的化学方程式__________________________________________。
(5)卡巴拉丁是老年人认知障碍的重要治疗药物。请结合上述合成路线及下面所给的反应:![]()
ROH+SOCl2RCl+HOSOCl
请写出合成卡巴拉丁流程中A、B、D的结构简式,C试剂的化学式。

A:____________、B:_____________、C:____________、D:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
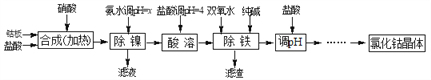
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是________________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于原电池的叙述正确的是( )
A.原电池放电时,电子由负极经电解质溶液流向正极
B.原电池是将电能转变为化学能的装置
C.在原电池中,电流流入的一极是负极,该电极发生氧化反应
D.构成原电池的正极和负极必须是两种不同的金属
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:

步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
【答案】 CO32-+H2O HCO3-+OH- C>B>D>A c(Na+)>c(CN-)>c(OH-)>c(H+) B = <
【解析】(1). Na2CO3是强碱弱酸盐,碳酸根离子发生水解:CO32-+H2O HCO3-+OH-,使溶液呈碱性,故答案为:CO32-+H2O HCO3-+OH-;
(2).由表中数据可知,酸性强弱顺序为:CH3COOH> H2CO3> HCN>HCO3-,根据越弱越水解的规律可知,离子的水解程度:CO32->CN->HCO3->CH3COO-,则等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3四种溶液的pH由大到小的顺序为:C>B>D>A,故答案为:C>B>D>A;
(3).在25℃时,将HCN溶液与NaOH溶液等体积等浓度混合后,二者恰好完全反应,得到NaCN溶液,因Na+不水解而CN-水解,所以c(Na+)>c(CN-),CN-水解使溶液呈碱性,则c(OH-)>c(H+),因盐的水解反应是微弱的,则c(CN-)>c(OH-),所以此溶液中离子浓度由大到小的顺序是:c(Na+)>c(CN-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);
(4).A.常温下,0.1 mol·L-1的CH3COOH 溶液加水稀释,促进醋酸的电离,使醋酸电离平衡正向移动,n(H+)增大,但c(H+)和c(CH3COO-)减小,故A错误;B. 根据Ka= 可知,
可知, 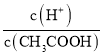 =
= 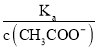 ,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故
,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故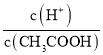 =
= 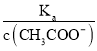 增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
(5).pH相同的不同醋酸和盐酸中,氢离子浓度相同,反应刚开始时,与Zn反应速率的相同;因醋酸是弱酸,醋酸中酸的浓度大于氢离子浓度,盐酸中酸的浓度等于氢离子浓度,所以醋酸的浓度大于HCl的浓度,则所得氢气的质量:m(H2)盐酸<m(H2)醋酸,故答案为:=;<。
点睛:本题主要考查弱电解质的电离平衡和溶液中微粒浓度的大小比较,题目难度不大。本题的易错点是第(4)小问,分析时既要结合平衡移动原理,也要善于利用平衡常数只与温度有关进行判断,如比较c(H+)/c(CH3COOH)时,可以根据Ka=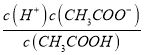 得出:
得出: 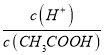 =
= 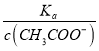 ,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故
,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故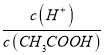 =
= 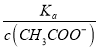 增大,可以快速解决此类问题。
增大,可以快速解决此类问题。
【题型】综合题
【结束】
25
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________(中和热数值为57.3kJ/mol)。
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是__________________________。
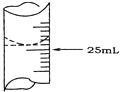
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为___________。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com