
科目: 来源: 题型:
【题目】下列反应中,产生氢气速度最快的是( )
A.常温下铝与6mol/L的硝酸B.常温下镁与3mol/L的醋酸
C.常温下铁与3mol/L的盐酸D.常温下镁与3mol/L的硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
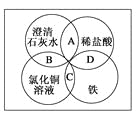
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应: 3A(g)+B(g) ![]() 3C(g)+2D(g),经5 min后,测得D的浓度为0.5mol/L,n(A)∶n(B)=3∶5。求:
3C(g)+2D(g),经5 min后,测得D的浓度为0.5mol/L,n(A)∶n(B)=3∶5。求:
(1)此时A的浓度c(A)=_________mol/L,
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________ mol。
(3)B的平均反应速率:v(B)=__________mol/(L·min)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
A. 1molCO 完全燃烧,放出热量为283 J
B. Na2O2(s)+CO2(s)=Na2CO3(s)+ ![]() O2(g) △H=-226 kJ·mol-l
O2(g) △H=-226 kJ·mol-l
C. CO(g) 与Na2O2(s)反应放出509kJ 热量时,电子转移数为1.204×1024
D. CO 的燃烧热为566 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填写下列相关内容:
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=_______。某温度时,水的离子积常数 Kw=1×10-13.在此温度下,将 pH=a 的硫酸溶液 VaL与 pH=b的 NaOH 溶液 VbL 混合,若所得混合液为中性,如果 a+b=12,则 Va:Vb=_______。
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)______0.2mol/LMOH 溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_______mol/L。
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃时,H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7 H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10-11 HClO Ka=3.0×10﹣8 饱和 NaClO 溶液的浓度约为 3mol/L.
(1)室温下,0.1mol/L NaClO 溶液的 pH _____0.1mol/L Na2SO3 溶液的 pH.(选填“大于”、小于”或“等于”)。浓度均为 0.1mol/L 的 Na2SO3 和 Na2CO3 的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为_______________。
(2)下列离子反应正确的有:__________。
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为 NaClO,还含有一定量的 NaOH 等,下列用来解释事实的方程式中不合理的是:__________。
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的 pH 约为12,主要是因为:ClO﹣+H2O![]() HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成 HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol 下列气体分别与 1L0.l mol·L﹣1 的 NaOH 溶液反应,形成的溶液的pH 由大到小的顺序为:_________(用 A、B、C 表示).
A.SO3 B.SO2 C.CO2
(5)下列说法不正确的是(_____)
A.一定温度下,pH相同的氨水和氢氧化钠等体积混合后溶液pH不变
B.含等物质的量的 NaClO、NaHCO3 混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH 溶液加水稀释后,溶液中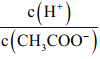 的值减小
的值减小
D.水中加入金属钠,虽反应生成了强碱氢氧化钠,但促进了水的电离
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为_________,S、O、N三种元素的第一电离能由大到小的顺序为_________。
(2)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4] (NO3)2。其中NO3-中心原子的杂化轨道类型为_________,[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有_________。
(3)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,CN-中提供孤电子对的原子是_________, lmol CN-中含有的π键的数目为_________。与CN-互为等电子体的离子有_________ (写出一种即可)
(4)CuSO4的熔点为560°C,,Cu(NO3)2的溶点为115°C,CuSO4溶点更高的原因是_________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O ,其晶胞结构如图所示。
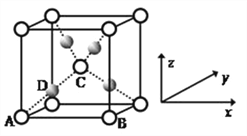
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0) ;C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
)。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是_________,该晶胞中Cu原子的空间利用率是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)![]() 2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
2NH3(g) H=-92.2 kJ·mol-1 ,据此回答以下问题:
(1)①某温度下,若把 10 mol N2 与 30 mol H2置于体积为 10 L 的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为 20%,则该温度下反应的K=_______ (可用分数表示)。
②对于合成氨反应而言,下列有关图像一定正确的是______(选填序号)。
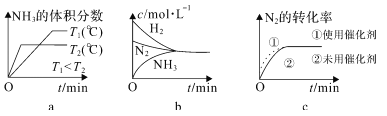
③在碱性溶液中通过电解法可以实现由 N2 制取 NH3:2N2+6H2O![]() 4NH3+3O2,阴极的电极反应式是_______________。
4NH3+3O2,阴极的电极反应式是_______________。
(2)室温下,若将 0.1 mol·L-1 盐酸滴入 20 mL 0.1 mol·L-1 氨水中,溶液 pH 随加入盐酸体积的变化曲线如下图所示。
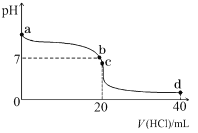
①NH3·H2O 的电离方程式是_______________。
②b 点所示溶液中的溶质是_______________。
③c 点所示溶液中,离子浓度从大到小的关系为_______________。
④常温下,若将 amol/LNH3·H2O 与等体积的 bmol/L 的盐酸混合,充分反应后溶液呈中性(不考虑氨水和盐酸的挥发),则该温度下 NH3·H2O 的电离常数Ka=___________(用含 a 和 b 的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com