
科目: 来源: 题型:
【题目】下列排列顺序正确的是( )
A.热稳定性:H2O>HF>H2SB.最高正化合价:F>N>C
C.酸性:H2CO3>H3PO4>H2SO4D.非金属性:Cl>S>Si
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃ 时,1LpH=1的H2SO4溶液中含有0.1NAH+
B. 常温常压下,18gD2O含有的质子数为10NA
C. 9.0g淀粉和葡萄糖的混合物中共含有0.3NA碳原子
D. 铜粉与硫粉混合加热,每消耗1mol铜粉,转移的电子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):
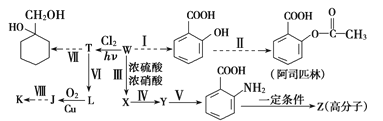
己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照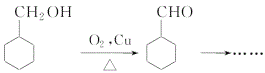 )_______
)_______
查看答案和解析>>
科目: 来源: 题型:
【题目】将铜锌合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:

回答下列问题:
(1)H2O2的电子式为_________;“溶解”后铜元素的主要存在形式是______(填离子符号)。
(2)“煮沸”的目的是除去过量的H2O2。298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为_______________。
(3)用缓冲溶液“调PH”是为了避免溶液的酸性太强,否则“滴定”时发生反应:
S2O32-+2H+=S↓+SO2↑+H2O
① 该缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________。
[已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5]
② 若100 mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,则v(Na2S2O3)=_____mol/(L·s)(忽略溶液体积变化的影响)。
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为_____________。
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN -):c(I-)≥_______________。
[已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15]
(6)下列情况可能造成测得的铜含量偏高的是______(填标号)。
A. 铜锌合金中含少量铁
B. “沉淀”时,I2与I-结合生成I3- :I2+I-=I3-
C. “转化”后的溶液在空气中放置太久,没有及时滴定
D. “滴定”过程中,往锥形瓶内加入少量蒸馏水
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,20g氖气所含有的原子数目为0.5NA
B. 2.8铁粉与50mL4 mol·L-1盐酸完全反应转移电子的数目为0.1NA
C. 标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA
D. 28g的C2H4和N2混合气体中含有的原子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)该反应的氧化剂是_______(填化学名称),氧化产物是_______(填化学式)。
(2)当有73.0克HCl被氧化时,消耗MnO2的物质的量为_______。
(3)当有0.2mol电子转移时,产生氯气的体积(标准状况)是_______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.铁是应用最广泛的金属,铁的卤化物、氯化物以及高价铁的含氧酸盐均为重要化合物。已知氧化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)某学习小组用下图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
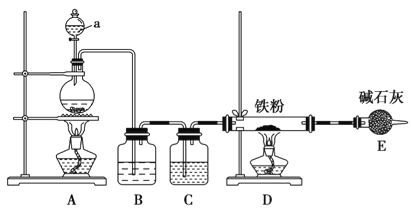
①装置A中发生的离子方程式_______________
②装置B的作用是________,C中的试剂______________。
③实验开始时先点燃___处酒精灯;装置E的作用为__________。
(2)工业上制备无水氯化铁的一种工艺流程如下:
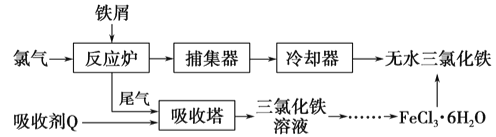
①吸收塔中发生反应的离子方程式为__________
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:____________
Ⅱ.利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
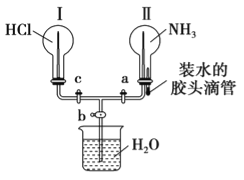
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是______。
(2)若先打开a、c活塞,再挤压胶头滴管(假设NH3不能被完全吸收),在烧瓶Ⅱ中可观察到的现象是_____。
(3)通过挤压胶头滴管和控制活塞的开关,要在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】气体体积的大小与许多因素有关.当温度和压强一定时,气体体积主要取决于( )
A.气体的种类
B.气体的物质的量
C.气体分子本身的大小
D.气体分子之间的平均距离
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(NA为阿伏伽德罗常数)( )
A. 58.5g NaCl含有σ键的个数为2NA
B. 12 g石墨中含有C--C键的个数为3NA
C. 12 g金刚石中含有C--C键的个数为2NA
D. 78 g苯中含有C==C键的个数3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com