
科目: 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法。郑州一中学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E 是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
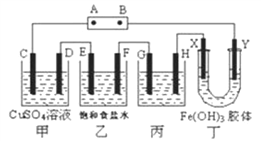
(1)电源B 极的名称是_______________。
(2)甲装置中电解反应的总化学方程式是:______________________。
(3)设电解质溶液过量,则同一时内C、D 电极上参加反应的单质或生成的单质的物质的量之比是________________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质) 精炼,G 极材料应该是___________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是__________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L (标准状况) 时,甲池中所生成物质的物质的量浓度为__________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包不纯的固体烧碱,其中可能含有Na2SO4、MgSO4、Ba(OH)2、NaCl中的一种或几种,取少量烧碱样品,按下图所示步进行实验:
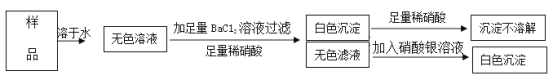
由此可推知该固体烧碱中一定含有__________;一定不含有______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所需的三大营养物质。以下叙述正确的是( )
A.植物油不能使溴的四氯化碳溶液褪色B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应D.蚕丝、羊毛、棉花的主要成分都是蛋白质
查看答案和解析>>
科目: 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图:
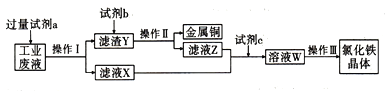
已知: FeCl3在加热情况下与水反应生成Fe(OH)3。
回答下列问题:
(1)试剂a是________,过量的原因是__________。操作I用到的玻璃仪器是__________。
(2)滤液X、Z中都有同一种溶质,请设计实验验证该溶质的离子:___________
(3)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是____nm,检验溶液中Fe3+存在的试剂是_________(填物质名称),证明Fe存在的现象是__________。电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶被与铜反应的离子方程式:______。
(4)若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是___________。
(5)硫铁矿烧渣的主要成分为Fe2O3、FeO、SiO2等,欲测定硫铁矿烧清中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤被中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。计算该样品中Fe元素的质量分数为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金属单质,B能参与植物的光合作用。C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质(图中部分生成物已省略)。

(1)用化学式表示: D________,G___________;
(2)写出E与F反应的化学方程式________________________;
(3)光合作用生成的淀粉在人体内变成葡萄糖(C6H12O6),葡萄糖在酶的催化作用下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】侯德榜是在中国化学工业史上一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,以下是侯德榜先生制碱工业的简要流程:
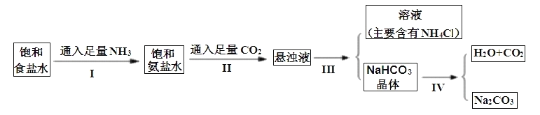
下表是四种物质在100g水中不同温度的溶解度,其中NH4HCO3水溶液呈碱性,性质不稳定,36℃时开始分解为二氧化碳、氨和水,60℃可以分解完。
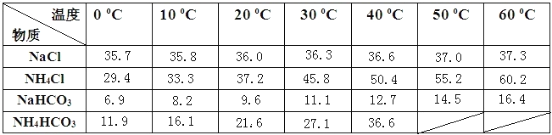
试回答下列问题:
(1)IV的反应条件是加热,请尝试写出IV的反应方程式:________________________。
(2)Ⅲ的操作名称叫____________。
(3)通过上述溶解度表,如何从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标之后,我国又将启动一项涉及千家万户营MgSO4养健康问题的“补铁工程”.卫生部已批准以酱油为食物载体,逐步开展补铁工程.这里的碘、铁指的是( )
A.元素
B.原子
C.分子
D.单质
查看答案和解析>>
科目: 来源: 题型:
【题目】钾、钙、钠、铁等活泼金属可以与水等反应,对其中可能的反应进行探究。为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究性学习小组设计了如图发生装置。

(1) Y液体可以选用__________ (填序号)。
A.苯 B.饱和的食盐水 C.四氯化碳
(2)实验前检验该装置气密性的方法是_______________。
(3)钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验] 将燃烧的钠迅速伸人盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附者黑色颗粒,瓶壁上粘附着白色物质。
[提出假设]
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3
假设3:白色物质是__________
[设计实验方案·验证假设] 该小组对燃烧后的白色产物进行如下探究:
实验操作 | 实验现象 | 结论 | |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加人无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部游于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
[思考与交流]
①钠在二氧化碳中燃烧的化学方程式为__________________。甲同学认为方案1得到的结论不正确,其理由是____________。
②丙同学认为白色物质有可能是氢氧化钠,你是否同意丙同学的观点,简述理由:__________
(4) 镁任空气中可以与CO2、O2、N2反应。也可以与NOx发生类似反应,氮化镁(Mg3N2) 是一种新型无机材料,纯净的氮化镁是淡黄色固体,热稳定性较好。氮化镁极易与水反应,该反应属于非氧化还原反应,产物是一种碱和一种气体。实验室探究金属Mg在NOx中的燃烧产物。同答下列问题:
①推测金属Mg在NOx中的燃烧产物为MgO、N2和Mg3N2,则反应的化学方程式为________。
②设计如图所示装置完成反应且验证产物中有N2 (夹持装置已略去,部分装置可重复使用)。

选择图中的装置,按气流方向将其连接,用接口字母表示的顺序为________。装置A中仪器名称为________,反应的化学方程式为__________。验证产物中有N2生成的现象为____________。
③检验Mg与NOx反应产物中是否存在Mg3N2的操作、现象和结论为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1,△S=bJ·mol-1·K-1 (a、b均为正数),达到化学平衡状态。
CH3OH(g) △H=akJ·mol-1,△S=bJ·mol-1·K-1 (a、b均为正数),达到化学平衡状态。

(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是_______(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是_____________(填字母)。
a.2v生成(CH3OH)=v生成(H2) b.压强不变
c.混合气体的密度不再改变 d.CO的体积分数不再变化
(3)如果反应从逆反应开始,将CH3OH充入容器a和b中进行反应。a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等。同温同压时,将等量的CH3OH充入初始体积相同的容器a、b中,反应同时开始。反应开始时,a与b中生成H2的速率va_______vb,反应过程中两容器里生成H2的速率是va_______vb,达到平衡时,a与b中CH3OH转化率相比较,则是aa______ab
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com