
科目: 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。![]() 固定装置已略去
固定装置已略去![]()
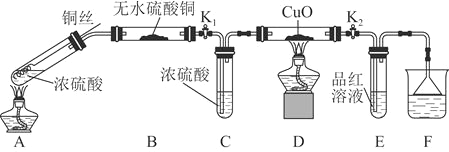
(1)A中反应的化学方程式为____________。
(2)F烧杯中的溶液通常是________________。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是______。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为_______。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸(mol/L) | 黑色物质出现的温度(℃) | 黑色物质消失的温度(℃) |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是_________。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用bmol/LNa2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为________。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B. 分别加水稀释10倍,四种溶液的pH ①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11∶9
查看答案和解析>>
科目: 来源: 题型:
【题目】
A、B、D、E、F为原子序数依次增大的前四周期元素,其中A的最外层电子数是其内层电子数的2倍,B、D、E为同周期元素,B原子的核外电子总数是其未成对电子数的5倍,E原子最外层有1个未成对电子,F原子核外有22种运动状态的电子。请回答下列问题:
(1)F元素位于周期表___________区,其价电子排布图为:___________。
(2)B、D、E三种元素中,第一电离能最小的是_______________________ (填元素符号);写出AD2的等电子体___________ (分子和阴离子各写一种)。
(3)AO2和DO2熔点高的是___________,原因是___________。
(4)B的单质和E的单质反应可形成原子个数比为1∶3的化合物M,M的立体构型为___________,中心原子的杂化轨道类型为___________。
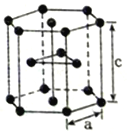
(5)元素F有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是F晶体的一种晶胞,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为___________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。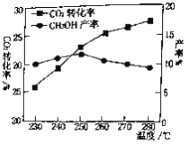
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)![]() CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K | 398 | 498 | … |
平衡常数/K | 126.5 | K1 | … |
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL,物质的量浓度均为0.l mol/L,下列说法正确的是( )
A. 四种溶液的pH大小顺序是③>②>①>④
B. 若分别加入25 mL 0.1 mol/L的盐酸充分反应后,pH最大的是①
C. 若将四种溶液稀释相同倍数,pH变化最大的是④
D. 升高温度,③溶液的pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
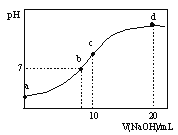
A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】分别将下列物质:①FeCl3 ②KMnO4 ③NaCl ④Ca(HCO3)2 ⑤Na2SO3 ⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干灼烧,能得到原物质的是( )
A. ②③ B. ③⑥ C. ①④ D. ⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】CN-可以造成水体污染,某小组采用如下方法对污水进行处理。
Ⅰ![]() 双氧水氧化法除NaCN。
双氧水氧化法除NaCN。
(1)NaCN的电子式为____________________________。
(2)碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为________________。
Ⅱ.CN-和Cr2O72-联合废水处理法。
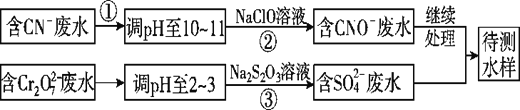
(3)②中反应后无气体放出,该反应的离子方程式为_____________________。
(4)步骤③中,每处理0.4mol Cr2O72-,至少消耗Na2S2O3________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com