
科目: 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )

A. 在阴极室,发生的电极反应为:2H2O + 2e 2OH -+ H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+ 浓度增大,使平衡2CrO42- + 2H+ ![]() Cr2O72- + H2O向右移动
Cr2O72- + H2O向右移动
C. 该制备过程中总反应的化学方程式为4K2CrO4 + 4H2O ![]() 2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
2K2Cr2O7 + 4KOH + 2H2↑+ O2↑
D. 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr) 为d,则此时铬酸钾的转化率为(1-d/2)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如右图所示,则X是( )
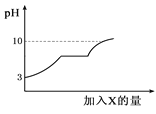
A. 浓硫酸 B. 澄清石灰水
C. 烧碱溶液 D. 纯碱溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置A中仪器a的名称为________。写出A中发生反应的离子方程式_________________________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理_______________________________________。
(2)选用图中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是__________________________________。
②丙同学设计的合理实验方案为:按照A→C→______→F→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是____________________________。
③其中裝置C的作用是____________________________。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol·L-1的KMnO4溶液吸收。充分反应后,再用0.2000 mol·L-1的KI标准溶液滴定过量的KMnO4,消耗KI溶液20.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为____g·L-1。
②若滴定前读数时平视,滴定终点读数时俯视则测定结果________(填“偏高”、“偏低”或“无影响”)。
【答案】 分液漏斗 CaSO3+2H+=Ca2++H2O+ SO2↑ SO2+2H2S=3S↓+2H2O 次氯酸在水溶液中能将SO2氧化,并非强酸制弱酸 B→E→D F中有沉淀后溶解,D不变色 除去挥发HCl 3.2 偏高
【解析】试题分析:(1)根据装置A分析仪器a的名称;A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水;SO2与H2S反应生成硫单质,能证明+4价的硫元素具有氧化性;(2)①次氯酸在水溶液中能将SO2氧化;②根据亚硫酸酸性大于碳酸、碳酸酸性大于次氯酸验证亚硫酸与次氯酸的酸性强弱;(3)①根据电子守恒计算SO2的含量;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小;
解析:(1)装置A中仪器a的名称分液漏斗;A中亚硫酸钙与盐酸反应生成氯化钙、二氧化硫、水,反应的离子方程式是CaSO3+2H+=Ca2++H2O+ SO2↑;SO2与H2S反应生成硫单质,能证明+4价的硫元素具有氧化性,反应方程式是SO2+2H2S=3S↓+2H2O;次氯酸在水溶液中能将SO2氧化,并非强酸制弱酸。所以按A→C→F→尾气处理顺序连接装置,不能证明亚硫酸和次氯酸的酸性强弱;②根据亚硫酸酸性大于碳酸、碳酸酸性大于次氯酸验证亚硫酸与次氯酸的酸性强弱;A中生成的SO2气体通过饱和NaHSO3溶液除去HCl,再通过饱和NaHCO3溶液生成二氧化碳气体,证明亚硫酸酸性大于碳酸,再通过高锰酸钾溶液除去CO2中的SO2,用品红溶液检验SO2已经除尽,再把CO2通入漂白粉溶液中,若D中品红不褪色、F中先有沉淀后溶解,证明碳酸酸性大于次氯酸;所以按照A→C→B→E→D→F→尾气处理(填字母)顺序连接装置。③其中饱和NaHCO3溶液的作用是除去挥发HCl。(3)①设10.00mL残液中SO2的质量是xg,根据电子守恒![]() ,x=0.032g,残液中SO2的含量为
,x=0.032g,残液中SO2的含量为![]() 3.2g·L-1;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小,根据上式可知测定结果偏高。
3.2g·L-1;②若滴定前读数时平视,滴定终点读数时俯视,消耗KI溶液体积偏小,根据上式可知测定结果偏高。
【题型】实验题
【结束】
9
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题: (1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。 (2)写出步骤Ⅰ中反应的总化学方程式为___________________________________。 (3)简述步骤Ⅱ中能析出KClO3晶体而无其他晶体析出的原因是_____________________________。 (4)已知MgCl2溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。 (5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。 (6)步骤Ⅳ中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_____。 A.N2 B.H2 C. CO2 D.空气 (7)海水中溴含量为65mg·L-1。若1L海水中95%溴元素被氧化为Br2经热空气吹出,溴单质残留量3%。最后用SO2将90%Br2还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】糯米中含大量淀粉,下列有关说法正确的是( )
A.淀粉能与银氨溶液反应产生银镜
B.淀粉是否水解完全可以用碘水来检验
C.淀粉在碱性条件下能发生水解生成葡萄糖
D.糖尿病病人不宜吃粽子,因为糯米中含大量的葡萄糖会使血糖升高
查看答案和解析>>
科目: 来源: 题型:
【题目】.现有四份体积、浓度均相等的AgNO3溶液,分别与等物质的量浓度的下列溶液恰好完全反应,所需溶液体积最小的是 ()
A.ZnCl2溶液B.NaCl溶液C.CaCl2溶液D.AlCl3溶液.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 含离子键的晶体不一定是离子晶体 B. 含共价键的晶体一定是分子晶体
C. 只含极性键的分子可能不是极性分子 D. 含非极性键的分子一定是非极性分子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,既属于氧化还原反应又属于置换反应的是( )
A.Fe2O3 + 3CO = 2Fe + 3CO2 B.Ca(OH)2 + CO2 = CaCO3↓+ H2O
C.CuO + H2 = Cu + H2O D.2Na + Cl2 = 2NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com