
科目: 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOy)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)NH3催化氣化可制备硝酸。
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-907.28kJ·mol-1
4NO(g)+6H2O(g) △H1=-907.28kJ·mol-1
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2=-1269.02kJ·mol-1
2N2(g)+6H2O(g) △H2=-1269.02kJ·mol-1
则4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H3_____。
5N2(g)+6H2O(g) △H3_____。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[a(NO)]与温度、压强的关系如下图所示。则p1____p2(填“><“或“=”);

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为p2MPa。则500℃时该反
应的平衡常数Kp=______,(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_____,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为______mol。

(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,
其电解原理如图所示。

①a电极为电解池的______(填“阴”或“阳”)极,写出该电极的电极反应式:_________;电解过程中
还会生成少量氧化性极强的气体单质,该气体的分子式是_________。
②已知同温时NH3·H2O的电离常数小于氢氟酸的电离常数,则0.1mo/LNH4F溶液中所有离子浓度由大到小的顺序为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除去杂质的实验方法正确的是( )
A.除去CO2中少量O2:用点燃的方法
B.除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤
C.除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥
D.除去CO2中的少量HCl:通入NaOH溶液后,收集气体
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)(1)已知在448℃时,反应H2(g)+I2(g)2HI(g)ΔH<0的平衡常数K1为49,则该温度下反应2HI(g)H2(g)+I2(g)的平衡常数K2为______;反应1/2H2(g)+1/2I2(g)HI(g)的平衡常数K3为_______.
(2)在某一密闭容器中发生上述反应,改变反应的某一条件(混合气体的总物质的量不变),造成容器内压强增大,则下列说法中正确的是_____
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.I2(g)的转化率增大,H2的平衡浓度变小
D.改变条件前后,速率图象如图所示
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______.
(2)该反应为______反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是______.
A.容器中压强不变 B.混合气体中c(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),判断此时温度为______℃.
(5)在800℃时,发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L (H2)=1.5mol/L 、 c(CO)=1mol/L 、 c(H2O)=3mol/L,则下一时刻,反应向_________填“正反应”或“逆反应”)方向进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修3:物质结构与性质】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式 , 。
(2)铜元素基态原子的电子排布式为 ,铜单质晶体中的原子堆积模型属于 堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是 (填元素符号),第一电离能最大的是 (填元素符号)。该晶体中的阴离子的立体构型是 ,阴离子的中心原子的杂化方式为 。
(4)氨的沸点 (填“高于”或“低于”)膦(PH3),原因是 。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是 。若该晶体的密度为ρg·cm-3,以NA表示阿伏加德罗常数,则该晶胞的边长为a= nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】在溶液中能大量共存,加入强碱溶液有沉淀析出,加入强酸有气体放出的是( )
A.Na+、Cu2+、Cl﹣、SO42﹣
B.Fe3+、K+、SO42﹣、NO3﹣
C.K+、Al3+、Cl﹣、CO32﹣
D.Na+、Ca2+、Cl﹣、HCO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】材料的应用推动了城市发展,很多方面涉及到了化学反应,认真回答下列问题:
(1)我国早在春秋战国就开始生产和使用铁器,写出用赤铁矿为原料炼铁的化学方程式:___________________。
(2)氢氧化钾是我国古代纺织业常用的漂洗洗涤剂,古人将贝壳(主要成分是碳酸钙)灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用,便可得到氢氧化钾。请按要求用化学方程式表示上述反应:分解反应:___________,化合反应:_____________,复分解反应:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能给合质子的分子或离子都是碱,按照这种理论下列物质既属于酸又属于碱的是 ( )
A. NaOH B. HCl C. NaH2PO4 D. Fe2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:该反应的热化学方程式为
________________________________
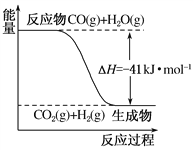
(2)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g) ΔH=________。
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g) ΔH=________。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
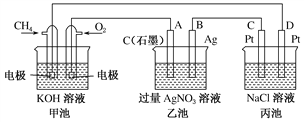
(1)甲池是________装置,乙装置中电极A的名称是____。
(2)甲装置中通入CH4的电极反应式为_______________________,乙装置中电极B(Ag)的电极反应式为_______________________
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com