
科目: 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况),它在光照条件下与氯气反应能生成3种不同的一氯代物。则该烃的结构简式是
A. 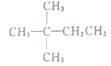 B. CH3CH2CH2CH2CH3
B. CH3CH2CH2CH2CH3
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】北京时间2015年10月5日,中国女科学家屠呦呦获诺贝尔医学奖,屠呦呦从中医古籍里得到启发,用乙醚从青蒿素提取出可以高效抑制疟原虫的成分——青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )

A. 青蒿素的分子式为C15H22O5
B. 青蒿素能与NaOH溶液反应
C. 青蒿素易溶于水、乙醇、苯等溶剂
D. 用乙醚从青蒿中提取青蒿素,用到了萃取的原理
查看答案和解析>>
科目: 来源: 题型:
【题目】直接电解吸收是烟气脱硝的一种有效方法。用6%的稀硝酸吸收NOx会生成亚硝酸,再将吸收液导入电解槽使之转化为硝酸。电解装置如下(阴、阳离子可通过隔膜,但分子不能通过):

下列说法不正确的是
A. 吸收NOx的过程涉及氧化还原反应
B. 石墨电极为颗粒状,可增大接触面积,提高电解效率
C. 当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值)
D. 极的电极反应式为HNO2-2e-+H2O=3H++N03-
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关叙述正确的是

A. pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>>c(H+)>c(OH-)
B. 由图可知该温度下醋酸的电离平衡常数为1×10-5.75
C. pH=3.5溶液中:c(Na+)+ c(H+)-c(OH-)+c(CH3COOH)=0.05mol/L
D. 向1LW点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)+2(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3: K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是___________________________________________
【设计、完成实验】
(1)称取_______g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和___________________________。
②下列操作会使所配溶液浓度偏低的是_______(填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
则x =________________,假设___________成立
(3)由于KMnO4能氧化水中有机物等因素,配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定并记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,
判断滴定终点的现象为_____________________________。上述实验中KMnO4溶液的物质的量浓度为_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,a L氢气在过量的bL氯气中燃烧,所得混合物用100mL3.00mol·L-1的NaOH溶液恰好完全吸收,则氯气的体积b为( )
A. 2.24L B. 4.48L C. 3.36L D. 1.12L
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C三种固体物质溶解度曲线如图所示。请回答:
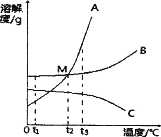
(1)图中M点表示_________________;
(2)t3℃时A、B、C三种物质的溶解度由小到大的顺序是____________;
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,溶质的质量分数由大到小的顺序是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A. 0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C. pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①=②>③
D. 0.2 mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(H+)>c(Al3+)>c(OH-)
【答案】C
【解析】根据质子守恒,0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故A错误;根据电荷守恒,NaF溶液中[c(Na+)-c(F-)]= [c(OH-)-c(H+)],CH3COOK溶液[c(K+)-c(CH3COO-)]= [c(OH-)-c(H+)],PH相等,所以[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)],故B错误; NH4Cl、(NH4)2SO4由于NH4+水解溶液呈酸性,pH相等,所以NH4+浓度相等,NH4HSO4溶液主要由于NH4HSO4电离呈酸性,所以NH4HSO4溶液中NH4+浓度最小,故C正确;0.2 mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混,完全反应生成氯化钠、氯化铝、氢氧化铝,所以c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D错误。
【题型】单选题
【结束】
8
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置A中仪器a的名称为________。写出A中发生反应的离子方程式_________________________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理_______________________________________。
(2)选用图中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是__________________________________。
②丙同学设计的合理实验方案为:按照A→C→______→F→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是____________________________。
③其中裝置C的作用是____________________________。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol·L-1的KMnO4溶液吸收。充分反应后,再用0.2000 mol·L-1的KI标准溶液滴定过量的KMnO4,消耗KI溶液20.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为____g·L-1。
②若滴定前读数时平视,滴定终点读数时俯视则测定结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com