
科目: 来源: 题型:
【题目】在下列有关离子共存的说法中,正确的是( )
A. 能使pH试纸显蓝色的溶液中可能大量存在K+、Ba2+、Cl-、Br-
B. 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
C. 含有大量Fe3+的溶液中可能大量存在SCN-、I-、K+、Br-
D. 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 LCO和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能说明HNO2是弱电解质的是
A. 常温下NaNO2溶液的pH大于7
B. 0.1 mol·L-1 HNO2溶液稀释至100倍,pH﹥3
C. HNO2和NaCl不能发生反应
D. 常温下pH=2的HNO2溶液与pH =12的NaOH溶液等体积混合后,溶液的pH小于7
查看答案和解析>>
科目: 来源: 题型:
【题目】研究大气中SO2的转化具有重要意义。
(1)二氧化硫-空气质子交换膜燃料电池是利用空气将大气中所含SO2氧化成SO42-,其装置示意图如下:
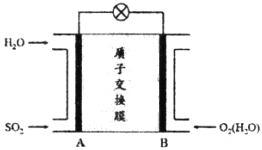
①质子(H+)的流动方向为_____________(填“从A到B”或“从B到A”)。
②负极的电极反应式为_____________。
(2)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
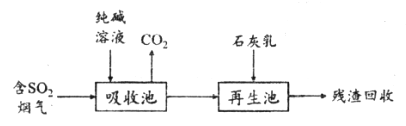
①用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是_____________。
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)铜元素位于元素周期表中的___区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是_______。
②在[Cu(NH3)4]SO4中,配离子所含有的化学键为________,提供孤电子对的成键原子是_______。
③ 除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为_______。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_____。但NF3不易与Cu2+形成化学键,其原因是____________。
(3)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____ g/cm3(不必化简,用NA表示阿伏加德罗常数)。
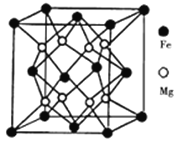
查看答案和解析>>
科目: 来源: 题型:
【题目】I.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)并测量其结晶水含量。己知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:

回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂____(填编号)
①KMnO4 ②K3[Fe(CN)6] ③NaOH ④KSCN
(2)试剂①是_____,试剂②是_____。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。沉淀洗涤的操作方法是________,根据实验数据测得x=_____(用含m、n的代数式表示)。
II.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。回答下列问题:

(4)所选仪器接口的连接顺序是A接______,______接______;B接______,______接______;___________请用离子方程式说明淀粉KI溶液变蓝的原因_____________________________。
(5)若装入的饱和食盐水为75mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(已转换成标准状况下的体积)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2moINO 和0.3moICO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(Lmin),则平衡后CO 的转化率为_______________。
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
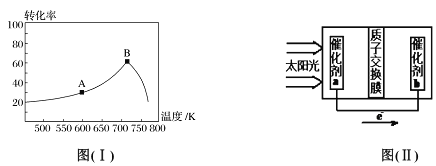
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:

①从悬浊液中将Mg(OH)2分离出来的操作名称为_____________。
②Mg(OH)2转化为MgCl2的离子方程式是_____________。
③由无水MgCl2制取Mg的化学方程式是_____________。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧所用仪器是下列中的哪一种_____________(填字母序号)。
a. 蒸发皿 b. 坩埚 c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:__________________________。
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是_____________(填字母序号)。
a. 乙酸 b. 四氯化碳 c. 硝酸 d. 苯
查看答案和解析>>
科目: 来源: 题型:
【题目】选择下列实验方法分离物质,将分离方法的序号填在横线上. A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离粗盐中混有的泥沙 .
(2)分离碘和水的混合物 .
(3)分离水和汽油的混合物
(4)分离酒精和水的混合物 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com