
科目: 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质的相互关系正确的是( )
A.同位素:H+、H2、2H、3H
B.同素异形体:C60、C70、C(石墨)
C.同分异构体:C3H8、C4H10
D.同系物:正丁烷、异丁烷
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
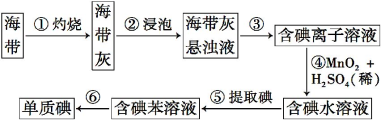
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】将适量铁粉放入Fe2(SO4)3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等.则已经反应的Fe3+和未反应的Fe3+物质的量之比为( )
A.2:3
B.3:2
C.1:2
D.2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】铬和铜都是人体所必需的微量元素。回答下列问题:
(1)铬原子的最高能层符号是_______,其价层电子的轨道表达式(电子排布图)为_______。
(2) 比较第二电离能Cu______Zn(填“>”、“=”、“<"),理由是_________。
(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,已知该氧化物中铬为+6价,请写出CrO5的结构式___________。
(4)氧化亚铜溶于浓氨水中形成无色配离子[Cu(NH3)2]+,则该配离子中铜的化合价为________,杂化类型为_________。[Cu(NH3)2]2SO4中阴离子的立体构型是_________。
(5)已知图1为铬的晶胞结构图,则铬晶胞属于______堆积,晶跑中实际拥有的铬原子数为_______;图2是铜的晶胞结构图,若其立方晶胞参数为a nm,该晶胞中原子的体积占晶胞体积的百分率为_______。
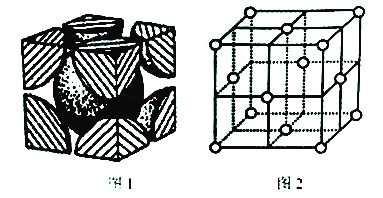
查看答案和解析>>
科目: 来源: 题型:
【题目】在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到60s时体系达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是:
A. 平衡时,N2O4的转化率为60%
B. 平衡时,体系内NO2为0.12mol·L-1
C. 其它条件不变,平衡后再往该密闭容器中通入0.5molN2O4气体,重新达到平衡时N2O4的体积百分数减少
D. 其它条件不变,平衡后再往该密闭容器中通入1molN2O4气体,重新达到平衡时该反应平衡常数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
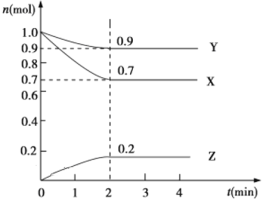
(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0~2分钟内的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:____________。

(2)“弱碱性按盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、_______。(请另写出一点原因)

(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g) △H=p的催化剂,其催化原理如图3所示。
2SO3(g) △H=p的催化剂,其催化原理如图3所示。

①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g)△H=q;
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(g)△H=r
请写出过程c的热化学方程式:_________________。
②t2℃下,反应:2SO3(g)![]() 2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。

(4)全钒夜流电池是一种可充电电池,装置如图所示。若在放电过程中有H+从A池移向B池,则:
①放电过程中,起负极作用的是_______池(填“A”或“B”)。
②充电过程中,阳极方程式为____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是______(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L(用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH调整为3,则溶液中Al3+浓度为_____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com