
科目: 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(l);△H1=-285.8kJ/mol
N2(g)+2H2(g)=N2H4(l);△H2=+50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_____________。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H>0。
HCN(g)+3H2(g) △H>0。
①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为66.67%。0~4min內,用H2表示的该反应速率v(H2)=_____。
保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时v正___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
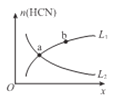
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n (HCN) 与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+ (aq)+2NH3 (aq)==Ag( NH3)2+(aq )时,其平衡常数的表达式为K稳=_______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3 (aq)![]() Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示发置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
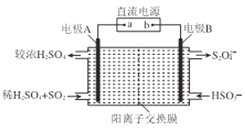
①电极A的电极反应式为______________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体。同时有SO32-生成。该反应离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分子或离子①F- ②Na+ ③HF ④NH3⑤CH4其中与氖原子含有相同电子数的是( )
A. ①②③ B. ②③④ C. ①②⑤ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN 等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯睛(C3H3N)和副产物丙烯醛(CH2=CHCHO)的热化学方程式如下:
① C3H6(g)+NH3(g)+O2(g)=C3H3N(g)+3H2O(g)△H=-515kJ/mol
② C3H6(g)+O2(g)=C3H4O(g)+H2O(g) △H=-353kJ/mol
有利于提高丙烯腈平衡产率的反应条件是______;提高丙烯腈反应选择性的关键因素是_____.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是_____;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D. 反应活化能增大
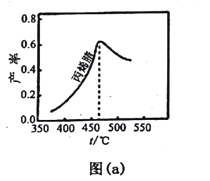
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为_________ ,理由是_______。进料氨、空气、丙烯的理论体积约为____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述正确的是
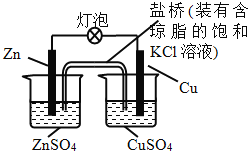
A. 盐桥中的K+移向ZnSO4溶液
B. 电流从锌片经导线流向铜片
C. 铜片质量逐渐减少
D. 铜离子在铜片表面被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目: 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。

①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
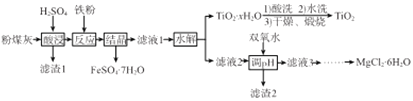
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
(1)“酸浸”时TiO2发生反应的离子方程式为_______________。
(2)“反应”时加入铁粉的作用为_______________。
(3)“结晶”需控制在70℃左右,温度过高会导致的后果为_____________。
(4)“水解”反应的离子方程式为______________。所得TiO2xH2O 沉淀进行酸洗的目的为____________。
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为________。
(6)实验室用MgCl2溶液制备MgCl26H2O,需进行的操作为_____、降温结晶、过滤、洗涤、干燥。
(7)FeSO47H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO47H2O的质量分数为____ (用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4 溶液,溶液中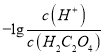 和-lgc(HC2O4-)或
和-lgc(HC2O4-)或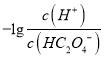 和-lgc(C2O42-)关系如图所示,下列说法正确的是
和-lgc(C2O42-)关系如图所示,下列说法正确的是
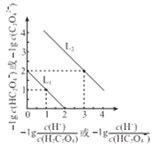
A. 曲线L1表示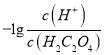 和-lgc(HC2O4-)的关系
和-lgc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 向0.1mol/LH2C2O4溶液中加入少量水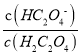 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com