
科目: 来源: 题型:
【题目】“一酸两浸,两碱联合”法是实现粉煤灰(含SiO2、Al2O3、Fe2O3、CaO、MgO等)综合利用的新工艺。工业流程如下:

回答下列问题:
(1)聚合氯化铝铁(PAFC)化学式为[Al2(OH)nCl6-n]m·[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂,PAFC中铁元素的化合价为___________。
(2)“一酸两浸”中的酸是________________(填结构式)。
(3)实际工业中“酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为_____________、 ________________。
(4)“滤液B”的主要溶质有_____________(填化学式)。滤液混合后“蒸发”的作用是____________________________________。
(5)“电解”时的化学方程式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
A.倾出标线以上的液体
B.吸出标线以上的溶液
C.影响不大,不再处理
D.重新配制
查看答案和解析>>
科目: 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目: 来源: 题型:
【题目】4molL﹣1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为( )
A.4 molL﹣1
B.0.2molL﹣1
C.2 molL﹣1
D.0.4 molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
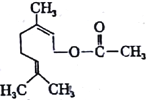
①1mol该有机物可消耗3molH2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A. ②③⑤ B. ①④⑤ C. ①②③ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为不同化学元素组成的化合物示意图,以下说法正确的是( )
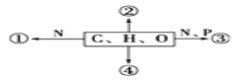
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②大量积累于皮下和内脏器官周围,则②是磷脂
C. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
D. 若③为生物大分子,则一定被甲基绿染成绿色
查看答案和解析>>
科目: 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是

A. 电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池充电时间越长,电池中的Li2S2量越多
C. 电解质中加入硫酸能增强导电性
D. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(I)写出下列反应的热化学方程式。
(1)N2(气态)与H2(气态)起反应,完全反应生成34g NH3(气态)放出92.2 kJ的热量:________________________________________。
(2)标况下22.4L N2(气态)与适量O2(气态)起反应,生成NO(气态)需吸收68 kJ的热量:______________________________________。
(3)卫星发射时可用肼(N2H4)为燃料,1 mol N2H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(气态),放出534 kJ的热量:__________________________________________。
(4)已知断裂1 mol H—H键、1 mol N≡N键分别需要吸收436 kJ、946 kJ的能量,生成1 mol N—H键放出391 kJ的能量,试写出N2(g)与H2(g)反应生成NH3(g)的热化学方程式:___________________________________。
(II)已知: C(s)+ O2(g) === CO2(g) ΔH=-393.5 kJ/mol
2CO(g)+O2(g) === 2CO2(g) ΔH=-566 kJ/mol
TiO2(s)+2Cl2(g) === TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s) === TiCl4(s)+2CO(g) ΔH= __________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在右图所示的装置(代替量热计)中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
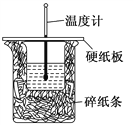
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
(5)实验中改用 50mL 0.50 mol· L-1的醋酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。简述理由______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 0.6mol过氧化钠晶体中所含阴离子的数目为1.2NA
B. 电解精炼铜时,若阳极质量减少6.4g,则阴极得到电子数为0.2NA
C. 标准状况下,22.4LCHCl3中含有的C-Cl键数为3NA
D. 常温常压下,4.0gD2O中含有的中子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com