
科目: 来源: 题型:
【题目】实验室中要测定部分变质的过氧化钠的纯度,可用如图装置实现。
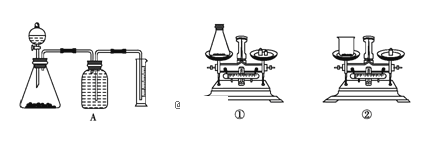
(1)锥形瓶中应放______,分液漏斗中放______,锥形瓶中发生反应的化学方程式为_______________________________。
(2)如图用托盘天平称取样品,应选用如图中的____(填“①”或“②”)。不选用另一装置的原因是_________________________________________________________。
(3)若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),计算样品中Na2O2的质量分数__(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请完成下列问题:
(1)M元素的简单离子的结构示意图为_______。
(2)Z在周期表中的位置为_____,其非金属性比W的非金属性____(填“强”或“弱”)。
(3)X、Z、W的原子半径由大到小顺序为_____________(填元素符号)。
(4)Y的氢化物化学式为______,该氢化物中化学键类型为________________(填“离子键”、“极性共价键”或“非极性共价键”)。
(5)W的单质与X的最高价氧化物的水化物反应的离子方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知漂白粉与浓盐酸反应产生氯气。反应方程式为:
Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O,
某同学为了测定氯气的体积并验证干燥氯气无漂白性,现有如图装置,请回答:
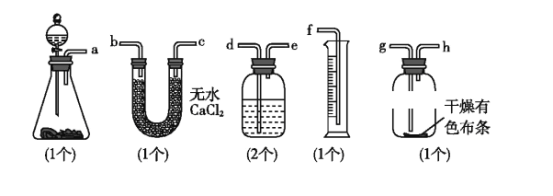
(1)请用字母填写装置的连接顺序:a接d、e接b、c接__、__接__、__接f。
(2)洗气瓶中所装液体是_______。
(3)在制氯气前,必须进行的一项操作步骤是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如右下:
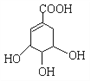
(1)A分子中官能团的名称是________________。
(2)A的分子式是_____________________。
(3)1mol A与氢氧化钠溶液完全反应,需要消耗NaOH的物质的量是_____________。
(4)A在浓硫酸作用下加热可得到 B(B的结构简式为![]() ),B的同分异构体中既含有酚羟基又含有酯基的共有__ 种,写出其中一种同分异构体的结构简式__________
),B的同分异构体中既含有酚羟基又含有酯基的共有__ 种,写出其中一种同分异构体的结构简式__________
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用乙炔燃烧产生的高温火焰来切割金属。若用R表示乙炔,其燃烧的化学方程式为:2R+3O2=4CO2+2H2O,则乙炔的化学式是( )
A.C2H4B.C2H2C.CH3COOHD.C2H6
查看答案和解析>>
科目: 来源: 题型:
【题目】已知C2H6O存在两种结构C2H5OH和CH3OCH3。分子式为C5H12O且不能和金属钠反应放出氢气的有机物有(不考虑立体异构)( )
A. 5种 B. 6种
C. 7种 D. 8种
查看答案和解析>>
科目: 来源: 题型:
【题目】在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中的共价键类型是
A. 仅有σ键 B. 三个σ键,两个π键
C. 两个σ键,两个π键 D. 三个σ键,一个π键
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
A.0.1 mol/L K2SO4 溶液中含有 K+为0.2 NA
B.2.4g镁离子所含电子数目为NA
C.足量铜与1L2molL﹣1稀硫酸反应可以生成H2分子总数为2NA
D.标准状况下,44.8 L CCl4中含2NA个分子
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.5 mol CH4的质量是________,在标准状况下的体积为________。
(2)3.1 g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为________,X的相对原子质量为________。
(3)0.6 mol的氧气与0.4 mol臭氧(O3)质量之比为________,分子个数之比为________,氧原子个数之比为________。
(4)8.5 g氢氧根离子含有的电子数目为________。
(5)14 g C2H4与C4H8的混合物所含质子的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以CO2表示的化学反应速率为__________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 _____(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
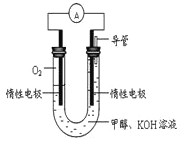
①该电池负极的电极反应为:_______________。
②该电池工作时,溶液中的OH-向______极移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com