
科目: 来源: 题型:
【题目】下列各组离子,能在水溶液中大量共存的是
A. K+、SO42-、HCO3-、H+ B. NH4+、Cl-、OH-、Na+
C. CO32-、Na+、K+、OH- D. Na+、Ag+、H+、I-
查看答案和解析>>
科目: 来源: 题型:
【题目】随着社会的发展,人类日益重视环境问题,下列做法正确的是( )
A.采用“绿色化学”工艺,使原料尽可能完全转化为所需要的物质
B.大量使用农药和化肥,提高农作物的产量
C.将氟利昂大量用于冰箱、空调的制冷剂
D.将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
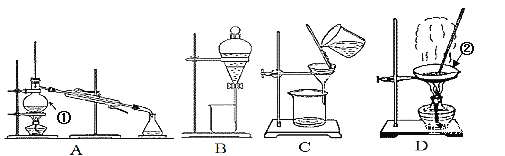
(1)装置A中仪器①的名称是______。
(2)从氯化钾溶液中得到氯化钾固体,应选择装置_____(填代表装置图的字母,下同)。
(3)分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)(已知四氯化碳和甲苯互溶),应选择装置______。
(4)从碘水中分离出I2,该装置的主要仪器名称是______,若用CCl4作为萃取剂,充分振荡后静置,观察到的现象是:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z原子序数依次增大,其中W元素原子的最外层电子数是内层电子数的两倍。X与Z同主族,两原子的核外电子数之和为24。Y的原子半径是所有短周期主族元素中最大的。下列说法正确的是
A. 简单离子半径:Z>Y>X
B. Y分别与X、Z形成二元化合物中不可能存在共价键
C. W、Y、Z的单质分别与X2反应时,条件不同产物均不同
D. 如右图所示实验可证明非金属性:Cl>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲烷实验室制法方程式为CH3COONa(s)+NaOH(s)![]() CH4↑+Na2CO3,装置如图所示。请回答:
CH4↑+Na2CO3,装置如图所示。请回答:

(1)下列气体的实验室制法发生装置与右图一致的是___________________。
A. 二氧化碳 B. 氢气 C. 氧气 D. 氯气
(2)气体收集完毕后,接下来的操作是___________________。
(3)反应后取试管中适量的固体溶于水,取上层清液滴加紫色石蕊试液,溶液显蓝色,说明NaOH仍有剩余,判断结论是否正确并说明理由___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢溴酸槟榔碱是驱除动物绦虫的有效药物,可由脂A(C4H6O2)经过如下合成路线获得:

已知:Ⅰ. 含碳碳双键的有机物与氨(NH3)或胺(RNH2)反应生成新的胺类化合物
如:R1CH=CH2 + RNH2![]() R1CH2CH2NHR
R1CH2CH2NHR
Ⅱ. R1COOR2 + R3CH2COOR4![]()
![]() + R2OH
+ R2OH
请回答:
(1)化合物E的结构简式___________________。
(2)下列说法不正确的是___________________。
A. 化合物A能发生还原反应,不能发生氧化反应
B. 化合物F能与FeCl3溶液发生显色反应
C. 化合物G具有碱性,可以生成内盐
D. 氢溴酸槟榔碱的分子式为C8H14O2NBr
(3)写出B+A→C的化学方程式___________________。
(4)写出化合物B可能的同分异构体的结构简式___________________,须同时符合:
① 分子结构中有一个六元环;
② 1H-NMR谱显示分子中有3种氢原子,IR谱显示有C-N键存在。
(5)设计酯A经路径二,通过两步反应转变为化合物E的合成路线(用流程图表示,所用试剂与路径一相同)___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型材料纳米级Fe粉具有广泛的用途,它比普通Fe粉更易与氧气反应,其制备工艺流程如下图所示:
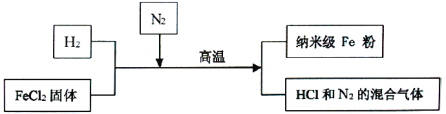
请回答下列问题:
(1)请补充完成上述制备工艺的化学方程式:H2+FeCl2![]() Fe+ ________。在制备纳米级Fe粉的工艺流程中,N2的作用是______________。
Fe+ ________。在制备纳米级Fe粉的工艺流程中,N2的作用是______________。
(2)研究人员发现最后制得的纳米级Fe粉样品中混有少量的FeCl2杂质。
①为除去样品中的杂质,在无氧环境下,先加______溶解,然后再______、洗涤、烘干。
②取样品20g,加入足量的盐酸,生成氢气0.7g。请计算该样品中单质Fe的质量分数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
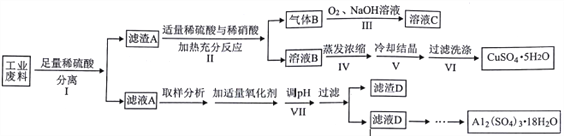
请回答:
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________。
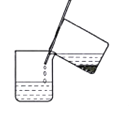
(2)写出步骤Ⅱ中发生反应的离子方程式___________________。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________。
(4)下列有关实验说法正确的是___________________。
A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a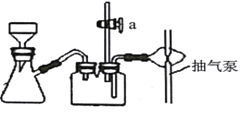
C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D. 步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1 mol·L-1 EDTA溶液V1 mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2 mol·L-1 ZnCl2溶液滴定过量的EDTA, 达到终点时消耗V2 mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666g mol -1,EDTA分别能与Al3+ 或Zn2+ 以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________(用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com