
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]甲苯是有机化工的一种重要原料,用它制取利尿“呋塞米”和重要的化工中间体“甲基丙烯酸苄基酯”的合成路线如下(部分步骤和条件省略):
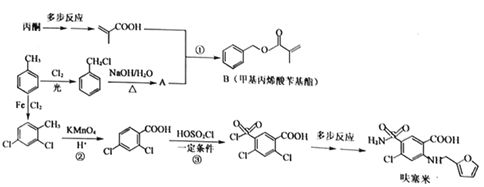
回答下列问题:
(1)A的名称为_________。
(2)反应类型:反应②_________;反应③_________。
(3)反应①的化学方程式_________。
(4)符合下列条件的B的同分异构体(不考虑立体异构)共有_________种。
①某环上只有两个取代基,且每个取代基上碳原子数不超过3个。
②与B具有相同的官能团,1mol该有机物完全水解需要消耗2molNaOH。
写出其中核磁共振氢谱只有5组峰的有机物的结构简式_________。
(5)下列说法正确的是_________。
A.呋塞米既可与强酸反应,又可与强碱反应
B.甲基丙烯酸是丙酸的同系物
C.1mol甲基丙烯酸和丙烯的混合物在氧气中完全燃烧共需要氧气4.5mol
D.可用溴水鉴甲苯和甲基丙烯酸苄基酯
(6)结合以下信息:
① ②RCN
②RCN![]() RCOOH
RCOOH
写出用丙酮和HCN为原料制备化合物![]() 的合成路线__________(其它试剂任选)。
的合成路线__________(其它试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】蒸馏水的制取:如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。

(1)A仪器的名称是________,B仪器的名称是________。
(2)实验时A中除加入少量自来水外,还需加入少量________,其作用是___________。
(3)指出图中两处明显的错误,并改正:
①____________________;
②______________________。
(4)收集完蒸馏水后,是先撤酒精灯还是先关闭冷凝水?____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子的结构如图所示,下列说法正确的是( )

A.N4属于一种新型的化合物
B.N4与N2的摩尔质量相等
C.等质量的N4与N2所含的原子个数比为1∶1
D.等质量的N4与N2所含的原子个数比为2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图所示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是________(填序号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是____________________________________。
(3)加氧化剂X的有关离子方程式是_______________________________。
(4)加氧化剂X的目的是_____________________________________________。
(5)为什么不能直接蒸发结晶得到CuCl2·2H2O晶体?____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】己二酸是一种重要的化工原料和合成中间体。已知:室温下,己二酸微溶于水,当温度由28℃升至78℃时,其溶解度可增大20倍。某实验小组利用绿色氧化剂H2O2氧化环己烯合成己二酸,反应和制备装置如下:
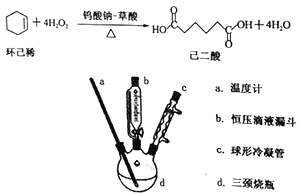
主要实验步骤:
①在100mL三颈烧瓶中依次加入1.50g钨酸钠0.57g草酸和34mL30%过氧化氢溶液,室温下磁力搅拌20min。
②用恒压滴液漏斗缓慢加入8.0mL的环己烯,继续搅拌并加热回流2小时,停止加热。
③将反应液迅速转入烧杯中,冷却至室温后再用冰水浴冷却,有大量晶体析出。抽滤,并用少量冰水洗涤,即可得到己二酸晶体粗品。
回答下列问题:
(1)本实验中使用带刻度的恒压滴液漏斗的主要作用有_________、_________。
(2)步骤③中用冰水洗涤晶体的目的是______________________________________。
己二酸晶体粗品可利用_________方法进一步获得纯品。
(3)取0.1480g己二酸(Mr=146.0)样品置于250mL锥形瓶中,加入50mL蒸馏水溶解,再加入2滴指示剂,用0.1000mol/Ld的NaOH标准溶液滴定至终点,消耗NaOH溶液的体积为20.00mL。
①本实验应选择_________(填“甲基橙”“石蕊”或“酚酞”)溶液作指示剂。
②判断滴定终点的方法是_________________________。
③样品中己二酸的质量分数为_________%(保留4位有效数字)。
(4)实验小组通过改变环己烯的用量来探究物料比对产率的影响,实验结果如下图所示。
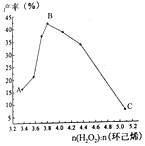
结合图像分析产率变化的可能原因:
①A点→B点:___________________________________________;
②B点→C点:____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是______。
(2)产生的气体在标准状况下的体积是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.所有物质里都含有化学键B.离子化合物中可能含有共价键
C.共价化合物中可能含有离子键D.水分子中的化学键是非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素周期表的说法不正确的是( )
A.元素周期表有7个横行,每一个横行是一周期
B.元素周期表有18个纵行,每一个纵行是一族
C.第ⅡA族元素全部是金属元素
D.第ⅦA族元素全部是非金属元素
查看答案和解析>>
科目: 来源: 题型:
【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com