
科目: 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
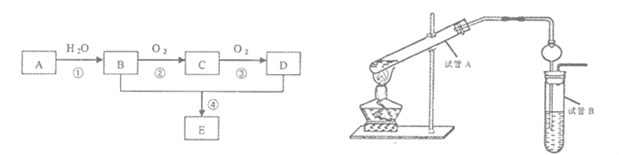
(1)写出步骤①的化学方程式_______________反应类型__________;
步骤②的化学方程式______________反应类型__________;
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_______________________;
②试管B中的试剂是______________________;分离出乙酸乙酯的实验操作是______________(填操作名称),用到的主要玻璃仪器为____________________;
③插入右边试管的导管接有一个球状物,其作用为_______________________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:
CH3—CH3+Cl2 ![]() CH3—CH2Cl+HCl
CH3—CH2Cl+HCl
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:
CH2=CH2+HCl→CH3—CH2Cl
你认为上述两位同学的方案中,合理的是____,简述你的理由:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E均为易溶于水的化合物,其离子组成如下表。(各化合物中离子组成不重复)
阳离子 | Na+、Al3+、Ag+、Ba2+、Fe3+ |
阴离子 | Cl-、CO32-、SO42-、NO3-、OH- |
分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1 molL B溶液pH>13;
②D溶液加入铜粉,溶液质量增加;
③在E溶液中逐滴滴入B至过量,先生成白色沉淀,后沉淀完全溶解;
④在A溶液中逐滴滴入氨水至过量,先生成白色沉淀,后沉淀完全溶解。
请回答下列问题:
(1)B的名称;_______________,E的名称;______________。
(2)C水溶液呈碱性原因:_____________(用离子方程式表示);0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,阴离子的总数:C溶液___________NaHCO3溶液。(填“>”或 “<”)
(3)D溶液呈________(填“酸性”“碱性”或“中性”)。若将D溶液加热蒸干得到固体应是__________(填化学式)。若将E溶液加热蒸干后再高温灼烧得到固体应是___________ (填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
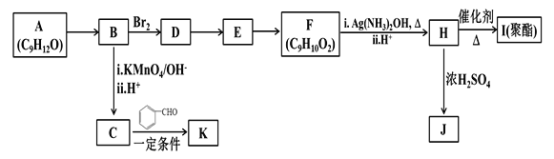
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②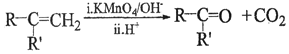
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(2) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为__________。
(3) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(4) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】以2氯丙烷为主要原料制1,2丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为( )
A. 加成反应→消去反应→取代反应
B. 消去反应→加成反应→取代反应
C. 消去反应→取代反应→加成反应
D. 取代反应→加成反应→消去反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是________________(填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_____________________(用离子方程式表示)
(2)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为____________________________
(3)25℃时,几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_____先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为____(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目: 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。

(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为_______________,检验滤液A中存在该离子的试剂为___________(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_________________________,在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)为使固体混合物D在空气中灼烧完全分解,应_____________,直至连续两次测定的实验结果相同(或质量相差小于0.1 g)时为止;灼烧时必须用到的实验仪器是__________。
(4)溶液G与固体混合物B反应的离子方程式为__________________________。
(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
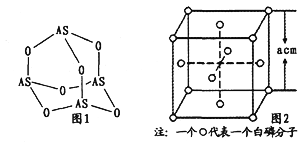
(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com