
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G、H是原子序数依次增大的八种短周期元素。A原子的电子层数与它的核外电子数相同,A与E、D与G分别为同主族,D的最外层电子数是次外层的3倍,含B元素的化合物种类最多,C的某种氧化物为红棕色气体,F为地壳中含量最多的金属元素,B与E的核外电子数之和与H的核外电子数相同。请回答下列问题:
(1)H在周期表中的位置是__________________________。
(2)A、D、E三种元素形成的化合物的电子式为________,所含化学键类型有_________。
(3)A2D的沸点高于A2G,其原因是__________________________。
(4)G、H的最高价氧化物对应水化物的酸性强弱__________(填化学式)。
(5)上述元素可组成盐R:CA4F(GD4)2。向盛有10mL 1mol/L R溶液的烧杯中滴加1mol/L NaOH溶液,沉淀物质的量随NaOH溶液体积的变化如下图所示:

①写出m点反应的离子方程式:_______________________。
②若在R中改加20mL 1.2mol/L Ba(OH)2溶液,充分反应,过滤,所得固体是_____。(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是 ( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A. ①③⑤ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种易挥发的液体,它是一种重要的化工原料,也是一种清洁能源。
(1)已知:①CO(g) + 2H2(g) ![]() CH3OH(l) ΔH=-128.1 kJ·mol-1
CH3OH(l) ΔH=-128.1 kJ·mol-1
②2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1
③H2(g) + 1/2O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
④2CO(g) + O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1
写出表示CH3OH燃烧热的热化学方程式:________________________________。
(2)不同温度下,将1.0 molCH4和2.4molH2O(g)通入容积为10 L的恒容密闭容器中发生如下反应: CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
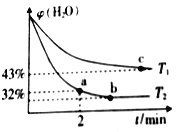
①T1____T2(填“>”“<”或“=”,下同),其对应的平衡常数K1____K2。
②温度T2下,从反应开始到2min时,ν(H2O)=___________。
③T1温度时,若已知到达平衡是H2O(g)的体积百分含量为40%,则该温度下上述反应的平衡常数K=____________。(保留两位小数点)
(3)科学家用氮化镓组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成了CH4。铜电极表面的电极反应式为__________________________。

(4)已知CO可与I2O5反应:5 CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
①滴定终点时溶液颜色变化为____________________________。
②气体样品中CO的体积分数为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶等行业。在CaCl2溶液中通入NH3和CO2可以制得纳米级碳酸钙。某化学兴趣小组设计如图所示装置制取该产品。D中装有蘸有稀硫酸的脱脂棉,图中夹持装置已略去。
可选用的药品有:a.石灰石 b.饱和氯化钙溶液 c.6mol/L盐酸 d.氯化铵e.氢氧化钙

(1)A中制备气体时,所需药品是______(选填字母序号)。
(2)B中盛有_____________溶液,其作用是___________________________。
(3)写出该实验中制取氨气的化学方程式________________________________。
(4)在实验中,向C中通入气体是有先后顺序的,应先通入的气体是_____(填化学式)。
(5)检验D出口处有氨气逸出的方法是_____________________________。
(6)写出制纳米级碳酸钙的化学方程式____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两种有机物(结构简式如下图),下列说法不正确的是
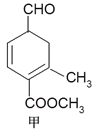
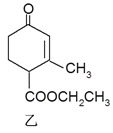
A. 二者与溴的CCl4溶液发生加成反应,消耗溴的物质的量分别为2mol、1mol
B. 甲、乙互为同分异构体
C. 1mol甲与H2在一定条件下反应,最多消耗3mol H2
D. 等物质的量的甲、乙分别与NaOH溶液反应,消耗NaOH的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在无色玻璃试剂瓶中
B.氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
C.少量的钠保存在煤油中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室常用的装置,请根据要求回答问题:
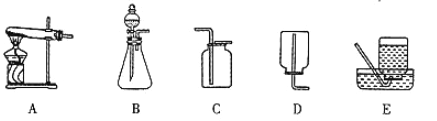
(1)实验室用氯酸钾和二氧化锰制取氧气的化学方程式为________________________,选用的气体发生装置是_________(填装置序号)。反应结束后,若要过滤分离出二氧化锰,除了玻璃棒外,还需要补充的玻璃仪器名称是__________、__________
(2)实验室可用碳酸钙固体与盐酸在常温下混合制取二氧化碳,选用的气体发生装置是________(填装置序号)。发生反应的化学方程式为:____________________________________
(3))下图中的C、D、E三种装置,均可用下图的F装置代替。若用F装置进行排空气法收集二氧化碳,二氧化碳应从F装置的_______(填“a”或“b”,下同)口通入;若用F装置进行排水法收集氧气,可先在F装置中装满水,然后将氧气从F装置的_______口通入。

(4)将二氧化碳通入紫色石蕊溶液中,溶液变成红色,加热后溶液又变成紫色。用化学方程式表示加热后溶液又变成紫色的原因是_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用下列仪器组装装置来直接验证有NO、NO2生成并制取氮化镁。(假设实验中每步转化均是完全的)

已知:①NO2沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生水解。
回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是(_____) (填序号)。
a. A→ D → C → F → B → F →E b. A→ C → D → F → B → F →E
c. A→ F → C → D → F → B →E d. A→ F → D → C → F → B →E
(2)确定还原产物中有NO2的现象是______________________________,实验中两次使用装置F,第二次使用装置F的作用是____________________________________。
(3)实验前需先打开开关K,向装置内通CO2气体,其目的是____________,当_______________时停止通入CO2。
(4)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式____________________________________________________。
(5)在A中反应开始时,某同学马上点燃B处的酒精灯,实验结束后通过测定发现B处的产品纯度不高,原因是______________________________________(用化学方程式回答)。
(6)验证B处有氮化镁生成的方法是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定25.00 mL NaOH溶液所得滴定曲线如图。下列说法正确的是

A. 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4—)= c(OH—)
B. 点②所示溶液中:c(HC2O4—)+2c(C2O42—)=0.0500mol·L-1
C. 点③所示溶液中:c(Na+)>c(HC2O4—)> c(H2C2O4) > c(C2O42—)
D. 滴定过程中可能出现:c(Na+)>c(C2O42—)=c(HC2O4—)>c(H+)>c(OH—)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,三种难溶电解质的溶度积如下表。
物质 | Ag2CrO4 | AgCl | AgBr |
Ksp | 1.0×10-12 | 1.8×10-10 | 7.7×10-13 |
下列说法正确的是
A. 向饱和AgCl溶液中通入少量HCl气体,溶液中c(Ag+)不变
B. 浓度均为1×10-6 molL﹣1的AgNO3、HBr溶液等体积混合后会生成AgBr沉淀
C. 常温下,以0.01 molL﹣1 AgNO3溶液滴定20mL0.01molL﹣1KCl和0.01molL﹣1K2CrO4的混合溶液,CrO42-先沉淀
D. 常温下,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=3.1×107
2AgCl(s)+CrO42-(aq)的平衡常数K=3.1×107
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com