
科目: 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
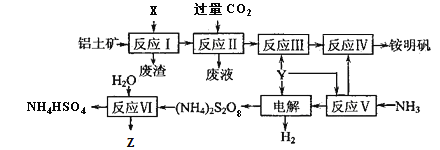
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。
(1)以CO2为原料制取碳(C)的太阳能工艺如图所示。

①过程1中每生成1molFeO转移电子数为_______________。
②过程2中发生反应的化学方程式为___________________________。
(2)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为△H =﹣283.0 kJ·mol-1
②H2O(l)= H2O(g) △H = + 44.0 kJ·mol-1
③2CH3OH(g)+CO2(g)![]() CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
(3)在密闭容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图所示,则:

①v(A)、v(B)、v(C)由快到慢的顺序为____________________;
②K(A)、K(B)、K(C)由大到小的顺序为___________________;
③下列能说明在此条件下反应达到平衡状态的是__________。
A.2v正(CH3OH)= v逆(CO2) B.CH3OH与CO2的物质的量之比保持不变
C.容器内气体的密度保持不变 D.各组分的物质的量分数保持不变
(4)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 molCO2和2 mol H2,测得有关物质的物质的量随温度变化如图所示。

①该催化剂在较低温度时主要选择________(填“反应Ⅰ”或“反应II”)。520℃时,反应II的平衡常数K=___________(只列算式不计算)。
②用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。b电极上的电极反应式为______。

查看答案和解析>>
科目: 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目: 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列六种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2,按照不同的分类标准,它们中有一种物质与其他五种有明显的不同,请找出这种物质,并写出分类的依据(至少要写出两种分类方法)。
①________________________________________________________________________;
②________________________________________________________________________。
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应。Na2O2与水反应的离子方程式是________。从反应中________,可以将化学反应分为氧化还原反应和非氧化还原反应,从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:________________________________________________________________________。
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__________,装置B中玻璃棒的作用是__________,防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是__________,①中加入沸石的作用是______________,冷却水的方向是_________。装置D在分液时为使液体顺利滴下,应进行的具体操作是_________。
(3)从氯化钠溶液中得到氯化钠固体,选择装置__________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置__________。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加________,不产生白色沉淀表明Cl-已除净。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.硫元素的不同单质S2与S8互为同素异形体B.35Cl2和37Cl2互为同位素
C.(CH3)2CHCH3和CH3(CH2)2CH3互为同分异构体D.甲苯和间二甲苯互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. H2、I2、HI平衡混合气加压后颜色变深
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】将少量氯水加入盛有KI溶液的试管中,加入适量的CCl4 , 然后振荡,静置,产生的现象是( )
A.溶液分层,上层几乎无色,下层紫红色
B.溶液分层,上层紫红色,上层几乎无色
C.溶液分层,上层几乎无色,下层橙红色
D.溶液呈紫红色
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(l)+3O2(g)﹦XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。
(1)反应前O2的体积是________mL(标准状况下)。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别是________和________(填元素符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验(夹持装置略去) 如下。请回答:

(1)制备Cl2发生装置可以_____(填大写字母),反应的离子方程式为____________________。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a![]() ______________________(按气流方向,用小写字母表示),若用到F,其盛装药品为____________________。
______________________(按气流方向,用小写字母表示),若用到F,其盛装药品为____________________。
(3)实验室可用下图装置制备亚硝酰氯(ClNO);

①实验室也可用B装置制备NO,X装置的优点为________________________________。
②检验装置气密性并装入药品,打开k2,然后再打开________(填“k1”"或“k3”),通入一段时间气体,(其目的为_________________________________________________),然后进行其它操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为__________________。
(4)取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体;
Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12),则亚硝酰氯(ClNO)的质量分数为_______________(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com