
科目: 来源: 题型:
【题目】(1) 25℃时,物质的量浓度均为0.1mol/L的下列四种溶液:
① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是_________________________。
(2)清除水瓶水垢中含有的CaSO4的方法是:将水瓶中的水垢用碳酸钠饱和溶液浸泡后加水冲洗,再加入盐酸即可,请写出上述反应的化学方程式:________________、_____________ 。
(3)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之____________________。
(4)电离平衡常数(用K表示)是一种平衡常数。电离平衡常数的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | HClO |
电离平衡常数(K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
氢氟酸的电离方程式为____________________,次氯酸电离平衡常数的表达式为_______________。
(5)25℃时,pH=3的HF溶液中,未电离的氟化氢物质的量浓度为_______________________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
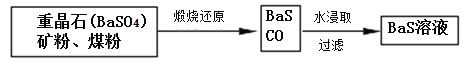
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+ ![]() H2↑+ Cl2↑
H2↑+ Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+ + 2OH-![]() CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O
CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O-![]() 2C6H5OH + 2CO32-
2C6H5OH + 2CO32-
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- == 5SO42- + 2Mn2+ 3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。

(1)写出装置甲的电解总反应方程式________________________________________。
(2)为完成上述实验,正确的连接顺序为E→_________________(填写连接的字母)。
(3)对硬质玻璃管里的氧化铜粉末进行加热前,需要先通一段时间某气体并检验该气体的纯度,检验该气体已经纯的具体的操作和现象为_______________________________。
(4)乙装置的a瓶溶液可选用__________________。
A.淀粉碘化钾溶液 B.酸性高锰酸钾溶液 C.硫化钠溶液 D.Fe(NO3)2溶液
(5)若a瓶中盛放过量的NaHSO3溶液,写出发生的离子反应方程式_____________________。
(6)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案。精确测量硬质玻璃管的质量为a g,加入CuO后,精确测量硬质玻璃管和CuO的总质量为b g , 实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
乙方案不足之处是________________________________________________________。
按甲方案进行计算,Cu的相对原子质量为__________。(用含a、b、c的式子来表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. N点所在曲线为pH变化曲线
B. M、N两点的溶液中NH4+的物质的量:M>N
C. Q点消耗盐酸的体积大于氨水的体积
D. 随着盐酸滴入,溶液导电性持续增强
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( ) ①NaHCO3②Al2O3③Al(OH)3 ④Al.
A.③④
B.②③④
C.①③④
D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.K+、Mg2+、NO3﹣、Cl﹣
B.Ba2+、Na+、CO32﹣、OH﹣
C.Mg2+、Ba2+、OH﹣、NO3﹣
D.H+、K+、CO32﹣、SO42﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)含氢原子8g的CH4所含原子总数是标况下____升H2所含原子总数的二倍。
(2)标况下,W g CO2与4.48 LH2的混合气体的总体积等于32g CH4的体积,求W=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有m克某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
(2)将质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为_______,该混合气体的平均摩尔质量为_________。
(3)同温同压下,质量相同的五种气体:① CO2 ② H2 ③ O2 ④ CH4 ⑤ SO2。
所占的体积由大到小的顺序是(填序号,下同)_________________;所含原子数由多到少的顺序是__________________________;密度由大到小的顺序是__________________。
(4)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO的质量是__g,CO2的体积是_____升。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com