
科目: 来源: 题型:
【题目】油脂不仅是营养物质和主要食物,也是一种重要的工业原料。下面是以油脂为主要原料获得部分产品的合成路线:

己知:①G (C10H10O4)分子中的官能团处于对位;
②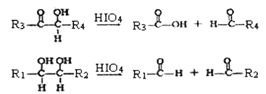
(R1、R2、R3与R4可能是氢、烃基或其他基团)
回答下列问题:
(1)下列关于油脂的说法正确的是____。(填标号)
a.油脂包括植物油和脂肪,属于酯类
b.天然油脂是混合甘油酯组成的混合物,无固定的熔点和沸点
c.油脂属天然高分子化合物,许多油脂兼有烯烃的化学性质
d.硬化油又叫人造脂肪,便于储存和运输,但容易被空气氧化变质
(2)G中官能团的名称为______,反应①的反应类型为_________。
(3)用系统命名法写出F的名称___________。
(4)在酸催化下物质的量的B与苯酚反应生成一种线型结构高分子的化学方程式为______________________。
(5)二元取代芳香化合物H是G的同分异构体,H满足下列条件:
①能发生银镜反应
②酸性条件下水解产物物质的量之比为2:1
③不与NaHCO3溶液反应。
则符合上述条件的H共有______种(不考虑立体结构,不包含G本身)。其中核磁共振氢谱为五组峰的结构简式为________(写出一种即可)。
(6)写出从HOCH2CH2OH![]() HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质],下列说法中不正确的是( )
2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质],下列说法中不正确的是( )
A. 放电时,溶液中的BF4-向负极移动
B. 放电时,转移1mol电子时正极减少的质量为119.5g
C. 充电时,阳极附近溶液的酸性减弱
D. 充电时,阴极的电极反应式为Pb2++2e-═Pb
查看答案和解析>>
科目: 来源: 题型:
【题目】已知苯分子为平面正六边形的结构,下列说法中错误的是( )
A. 苯分子中碳原子间形成的碳碳键完全相同
B. 苯分子中形成共价键的夹角都是120°
C. 苯分子中6个碳原子位于同一平面内
D. 苯分子中的碳原子与氢原子不在同一平面内
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸钠(NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分) ( )
A. 长期饮用碳酸饮料有利于牙齿健康
B. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
C. 提高CO2充气压力,饮料中c(A-)不变
D. 碳酸饮料中各种粒子的浓度关系为c(H+)=c(HCO![]() )+2c(CO
)+2c(CO![]() )+c(OH-)-c(HA)
)+c(OH-)-c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
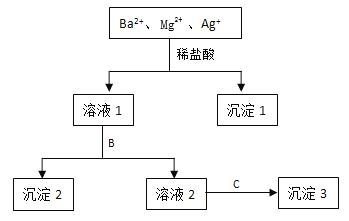
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是_____,证明Fe3+存在的现象是__________。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:_________________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

①请写出上述实验中③的化学式:_______
②配制并保存硫酸亚铁溶液时,常在其中加入_______________________
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为______。
①加入足量氯水 ②加入足量![]() 溶液 ③加入少量KSCN溶液
溶液 ③加入少量KSCN溶液
A、①③ B、③② C、③① D、①②③
④写出向②⑤的合并液中通入⑥的离子方程式__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空间构型为_______。
(3)有机物M(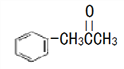 )在一定条件下生成N(
)在一定条件下生成N( )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解温度低于SrCO3的原因_____________。
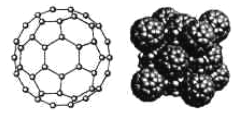
(5)碳的一种同素异形体C60,又名足球烯,是一种高度堆成的球碳分子。立方烷(分子式:C8H8,![]() )是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。
)是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。
(6)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:
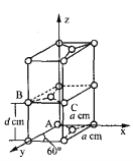
①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】等体积NaCl,MgCl2,AlCl3三种溶液分别于等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl,MgCl2,AlCl3三种溶液的物质的量浓度之比为( )
A.1:2:3B.3:2:1C.6:3:2D.1:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.AgCl悬浊液中存在平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水中含有较多的 Ca2+、Mg2+、HCO3—、SO42—,加热煮沸可以完全除去其中的Ca2+、Mg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度时,将n mol/L氨水滴入10mL 1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,有关说法正确的是( )
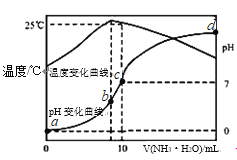
A. a点Kw=1.0×10﹣14 mol 2![]() L﹣2
L﹣2
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl﹣)>c(H+)>c(OH﹣)
D. 25℃ 时NH3·H2O的电离常数为![]() mol
mol![]() L-1(用n表示)
L-1(用n表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com