
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.摩尔既是物质的数量单位又是物质的质量单位
B.物质的量是国际单位制中七个基本单位之一
C.阿伏加德罗常数是0.012kg 12C中含有的碳原子数目
D.标准状况下,1molH2O所占的体积为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
I、(1)联氨分子的电子式为______________,
(2)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的方程式_______________。联氨与盐酸反应生成的正盐的化学方程式为__________________
II、某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl

实验一:制备NaClO溶液(实验装置如上图所示)
(1)配制30%NaOH溶液时,所需的玻璃仪器除量筒外,还有________(填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
实验二:制取水合肼(实验装置如右图所示)。

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是__________________________________________________
实验三:测定馏分中水合肼的含量。
称取馏分5.000 g,加入适量NaHCO3固体,加水配成250 mL溶液,移取25.00 mL,用0.100 0 mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5 左右。(已知:N2H4·H2O+2I2===N2↑+4HI+H2O)
(3)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_____________________。
(4)本实验用____________做指示剂,当滴定达到终点时的现象为_____________________。
(5)实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列操作中,所使用的仪器能够达到目的是( )
A.用5mL量筒准确量取4.55mL水
B.称量4.5g纯碱时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘
C.过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤
D.萃取操作时,选择萃取剂的密度可以比水大也可以比水小
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列无色透明溶液中,各组离子一定能够大量共存的是( )
A. Al3+、Na+、Cl﹣、OH﹣ B. Fe2+、Mg2+、SO42—、Cl﹣
C. K+、Na+、CO32—、OH﹣ D. Na+、Ba2+、HCO3—、OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图所示。

(1)电源的正极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为_________、_________。
(3)电解结束后,阴极室溶液的pH与电解前相比将__________;(填“增大”、“减小”或“不变”),若两极共收集到气体8.96 L(标准状况),则除去的尿素为________ g(忽略气体的溶解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在微生物作用下电解有机废水(含CH3COOH),可获得淸洁能源H2。其原理如图所示。下列有关说法不正确的是

A. 电源B极为负极
B. 通电后,若有0.1 mol H2生成,则转移0. 2 mol电子
C. 通电后,H+通过质子交换膜向右移动,最终右侧溶液pH减小
D. 与电源A极相连的惰性电极上发生的反应为CH3COOH-8e-+2H2O=2CO2↑+ 8H+
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________,NaHSO3溶液中的各离子浓度由大到小的顺序为________________。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
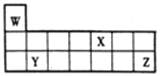
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com