
科目: 来源: 题型:
【题目】在一定温度、压强下,1体积X2(气)和3体积Y2(气)化合成2体积的气体化合物,则该气体化合物的化合式为( )
A.XY3
B.XY
C.X3Y
D.X2Y3
查看答案和解析>>
科目: 来源: 题型:
【题目】主族元素A和B可形成组成为AB2的离子化合物,则A、B两原子的最外层电子排布分别为( )
A.ns2np2和ns2np4B.ns2和ns2np4C.ns2和ns2np5D.ns1和ns2
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
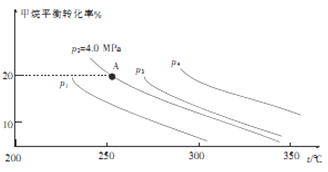
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
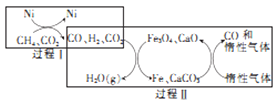
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。

(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
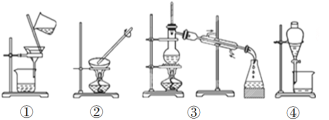
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为____________________________。

(2)从辉铜矿中浸取铜元素时,可用FeCl 3溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl下标2+S,每生成1molCuCl2,反应中转移电子的物质的量为_____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为_________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是________________。
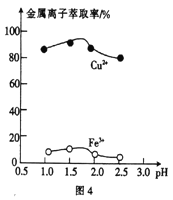
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是_________________。
(4)用“反萃取”得到的CuSO4 溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为_____。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_____、干燥、____等操作可得到Fe2O3 产品。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备三氯乙醛(CCl3CHO)的反应原理为:C2H5OH+4Cl2→CCl3CHO+ 5HCl,可能发生的副反应是C2H5OH+HCl→C2H5Cl+H2O。 某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:
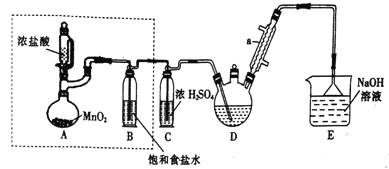
(1)仪器a的名称是______________。
(2)检查虚线框内装置气密性的方法是_________________。
(3)若撤去装置B,对实验的影响是_______________________。
(4)实验时发现D中导管口处气泡速率过快,合理的解决方法是_______________________。
(5)已知:CCl3CHO+OH-→CHCl3+HCOO- HCOO-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
称取0.40g产品,配成待测溶液,加入20.00mL0.100mol/L 碘标准溶液,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至终点。重复上述操作3次,平均消耗Na2SO3溶液20.00mL。滴定时所用指示剂是______,达到滴定终点的现象是_________,测得产品的纯度为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达不正确的是
A. 体积②>③>①>④ B. 密度②>③>④>①
C. 质量②>③>①>④ D. 氢原子个数③>①>②>④
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
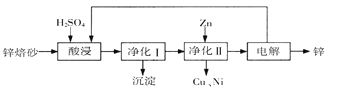
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式
②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃,![]() 。
。
③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(3)若没有净化II操作,则对锌的制备带来的影响是 。
(4)本流程中可以循环利用的物质除锌外还有 。
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确确是
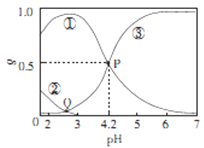
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol/L的NaHC204溶液中:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”在日常生活中被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用。已知,强酸弱碱形成的盐溶液呈酸性,则你认为“84消毒液”的有效成分是( )
A. 氯化氢 B. 次氯酸钠 C. 高锰酸钾 D. 碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com