
科目: 来源: 题型:
【题目】铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于 ______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)二氯二吡啶合铂是由Pt2+ 、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同 分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为 ______。
②吡啶分子是大体积平面配体,其结构简式如右图所示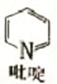 ,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有 _____(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由: ________。
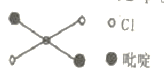
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是 _____分子(选填“极性”、“非极性”)。
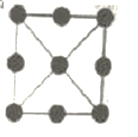
(3)金属铂立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=_____nm(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,具有相同体积的任何气体中含有的分子数相同.在一定温度和压强下,10体积气体A2跟30体积气体B2化合生成20体积某气体C,则气体C的化学式为( )
A.AB
B.A2B
C.AB3
D.AB2
查看答案和解析>>
科目: 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:
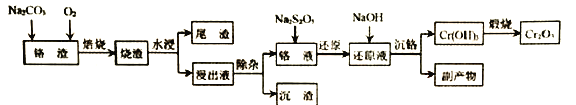
已知:Ksp[Mg(OH)2]=1.2×10-11,Ksp [Cr(OH)3]=6.4×10-31
(1)若以氧化物形式表示矿物的组成,Fe2SiO4可表示为______。
(2)焙烧时通入氧气的作用是 ______。
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43- 、AsO43- 、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。
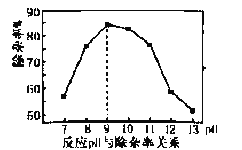
①反应过程控制溶液pH为9,若pH>9除杂率降低的原因是 ______。
②反应的温度控制在80℃左右,温度不宜太高的主要原因是_______。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)
①完成“还原”反应的离子方程式:_____________
![]()
②已知铬液中c(Cr2O72- )=0.32 mol/L ,为了不使还原过程产生Cr(OH)3沉淀,应 控制反应过程pH不大于 _____。
(5)“沉铬”主要副产物为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷单质及其化合物有着广泛应用。
(1)在1.0 L密闭容器中放入0.10mol PCl5(g),一定温度进行如下反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH1
PCl3(g)+Cl2(g) ΔH1
反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
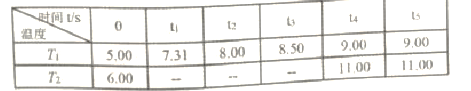
回答下列问题:
①PCl3的电子式为_______。
②T1温度下,反应平衡常数K=______。
③T1___T2(填“>”、“<”或“=”,下同),PCl5的平衡转化率α1(T1) __α2(T2)。
(2)PCl5、PCl3可转化为H3PO4、H3PO3。已知下列热化学方程式:
PCl5(g)+4H2O(l) = H3PO4(aq)+5HCl(aq) ΔH2
PCl3(g)+3H2O(l) = H3PO3(aq)+3HCl(aq) ΔH3
H3PO3(aq)+Cl2(g)+H2O(l) = H3PO4(aq)+2HCl(aq) ΔH4
则ΔH4= ______。(用ΔH1、ΔH2、ΔH3表示)
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。
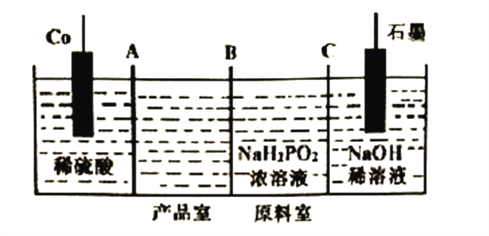
①Co的电极反应式为______________,A、B、C为离子交换膜,其中B为__________离子交换膜(填“阳”或“阴”)。
②次磷酸(H3PO2)为一元弱酸,次磷酸钠溶液中离子浓度由大到小的顺序是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是( )
A. Zn为电池的负极 B. 正极反应式为2FeO![]() +10H++6e-===Fe2O3+5H2O
+10H++6e-===Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度增大 D. 电池工作时OH-向负极迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1mol H2SO4中含_____mol O 。4mol NH4NO3与______ mol H2SO4所含氧原子数相同。1.204×1024个Mg变成Mg2+失去____ mol eˉ。
(2)4.5g水与___________ g硫酸所含的分子数相等。
(3)乙醇(C2H6O)水溶液中,当乙醇分子和水分子中氢原子个数相等时,溶液中乙醇的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】热稳定系数和总氯量是漂白粉行业标准里的两个指标。
Ⅰ.利用如图装置(省略加热装置),探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2。

(1)加热干燥漂白粉样品,观察到B中有大量无色气泡产生。则次氯酸钙分解的固体产物中一定有________。
(2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。
①B中发生反应的离子方程式为_______。
②待充分反应后,断开连接A、B的橡皮管,停止加热,冷却。利用B中产物,通过实验证明加热时有少量氯气生成。请设计实验方案:_________。
Ⅱ. 测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值)。实验步骤如下:
①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500 mL。
②移取25.00 mL该试样溶液至锥形瓶中,调节pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000mol/L AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液平均体积为25.00 mL。(已知:Ksp(AgCl,白色)=1.56×10-10,Ksp(Ag2Cr2O4,砖红色)=9.0×10-12)
(3)步骤①中,溶解、稀释的过程所用的玻璃仪器有烧杯、玻璃棒、____、 ____。
(4)加入H2O2水溶液,搅拌至不再产生气泡,目的是______(用离子方程式表示)。
(5)滴定终点的现象是_______。
(6)该漂白粉总氯的百分含量为__________。
(7)下列操作导致总氯百分含量测定结果偏高的是______。
A.指示剂K2CrO4的用量过多
B.在滴定终点读取滴定管刻度时,俯视标准液液面
C.滴定前滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)现有32 g某气体,摩尔质量为16 g·mol-1,则:
①该气体为___________ mol。
②该气体所含分子数为___________ NA。
③该气体在标准状况下的体积为_________ L。
(2) _________g H2O中的氧原子数目与标准状况下4.48 L CO2中的氧原子数目相同。
(3)同温同压下,同体积的氨气(NH3)和氧气的质量比是______,相同质量的氨气和氧气的体积比是_________;
(4)某元素1个原子的质量为a g,1 个 12C原子质量为b g,则该元素的这种原子的相对原子质量数值是_________或_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是

A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com