
科目: 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制氧气 | H2O2―→O2 | |
② | 制氨气 | NH4Cl―→NH3 | |
③ | 制氯气 | HCl―→Cl2 |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是____填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中_______。
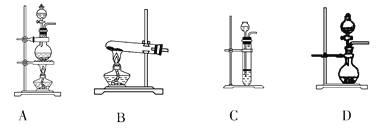
(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的______填序号):

②配制过程中,除上图所列仪器外,还需要的仪器有________、________、______。
查看答案和解析>>
科目: 来源: 题型:
【题目】对化学反应速率与化学反应限度的叙述,不正确的是( )
A.当化学反应达到最大限度时反应速率为0
B.同一化学反应,若反应条件不同,限度可能不同
C.化学反应达到限度时,正逆反应速率相等
D.化学反应的限度与时间的长短无关
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铝在现代生产和日常生活中应用广泛。工业上用电解熔融氧化铝的方法来制取金属铝,纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。反应方程式为2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(1)在电解时阴极的电极反应式_________________,阳极的电极反应式_____________________。
(2)对金属制品进行抗腐蚀处理,可延长其使用寿命,以铝材为阳极,在H2SO4溶液中电解,可使铝材表面形成氧化膜,阳极电极反应式为________________________。在电解过程中,阴极附近溶液的pH________(填“增大,减小或不变”)
(3)“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2=2AlI3,该电池负极的电极反应为:_____________________________,当负极质量减少27g时,在导线有________个电子通过。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、选择下列实验方法分离物质,将分离方法的字母填在横线上。
A.萃取分液法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法 F.升华法
(1)______________分离饱和食盐水与沙子的混合物。
(2)______________分离水和汽油的混合物。
(3)______________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4)_____________从碘的水溶液里提取碘。
Ⅱ、蒸馏是实验室制备蒸馏水的常用方法。
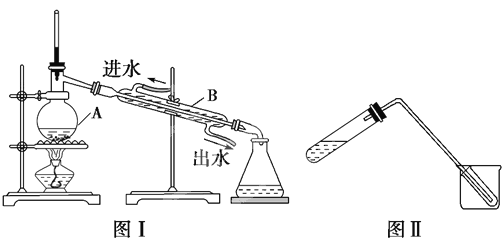
(1)图Ⅰ是实验室制取蒸馏水的常用装置,图中明显的错误是_____________________。
(2)仪器A的名称是______________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入少量________________,其作用是________________________________________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图Ⅰ完全相同。该装置中使用的玻璃导管较长,其作用是_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定100mL浓度均为0.1mol·L-1 的三种酸(HM、HN和HR) 溶液,滴定的曲线如图所示,下列判断错误的是( )
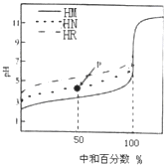
A. 三种酸的电离常数关系: KHR>KHN>KHM
B. pH=7时,三种溶液中:c (M-) >c (N-)>c (R-)
C. 滴定至P点时,溶液中:c (Na+) >c (N-) >c (HN) >c (H+) >c (OH-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR) =c(OH-)-c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】侯氏制碱法制得的NaHCO3固体中含有部分Na2CO3·nH2O(n<10)。取该固体8.50g充分加热,产生的气体依次通过浓硫酸(增重1.44 g)和碱石灰(增重1.76 g)。
请计算:
(1)固体中NaHCO3的质量为_________g。
(2)固体中Na2CO3·nH2O的n值为 ___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高温下焦炭、石英砂的混合物与氯气反应可生成SiCl4。以下是实验室制备SiCl4的装置示意图(注:S1Cl4遇水易水解)。
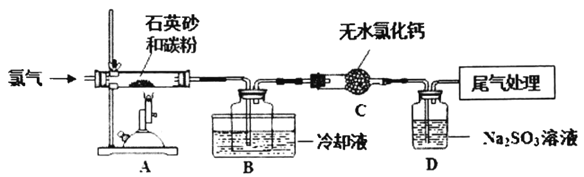
请回答:
(1)用MnO2和浓盐酸制取氯气,为了得到纯净干燥的氯气,可将制得的氯气依次通过盛有____、浓硫酸的洗气瓶。
(2)装置C的作用是______。
(3)设计一个实验方案,用化学方法检验装置D中生成的SO42-_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究矿石样品A(仅含两种元素)的组成和性质,设计并完成如下实验:

已知溶液D中只含一种金属阳离子,与铁粉充分反应后固体质量减少14 g。
请回答:
(1)样品A的化学式为________________。
(2)写出气体c与溴水反应的离子方程式___________________。
(3)写出样品A与盐酸发生氧化还原反应的化学方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生
D.一定有电子转移(得失或偏移)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com