
科目: 来源: 题型:
【题目】完成下面有关组成细胞主要化合物的概念图:
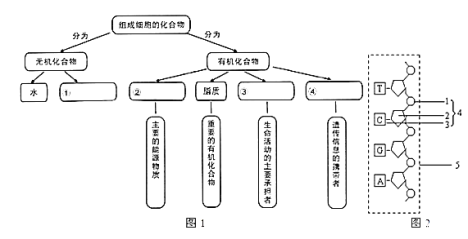
(1)写出图1中化合物的名称:①________②________③________④_______
(2)图1的②中被称为生命的燃料的是__________,脂质中构成细胞膜重要成分的是________,
(3)图2为图1中④的一条长链,1、2的名称分别是________、_________。该结构中特有的碱基名称是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对工业废气物进行脱硫(SO2)处理并加以利用,不仅可防止大气污染,还能实现一定经济效益。回答下列问题:
(1)热化学碘硫循环脱硫,涉及以下三个反应:
bunsen反应:SO2(g)+I2(g)+2H2O(l)═2HI (g)+H2SO4(l) △H
硫酸分解反应:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=+462kJ·mol-1
碘化氢分解反应:2HI(g)=H2(g)+I2(g)△H=+10kJ·mol-1
已知氢气的燃烧热为286kJ·mol-1,则bunsen反应的△H=_________kJ·mol-1。
(2)在活性炭催化下,SO2与Cl2发生反应:SO2(g)+Cl2(g)![]() SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。
SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。
①SO2Cl2能与水发生非氧化还原反应,生成两种酸,则这两种酸的化学式为_________。
②下列事实中,不能作为判断硫元素和氯元素非金属性强弱的依据是_________(填字母)。
A.硫化氢的分解温度为300℃左右,氯化氢1500℃才分解
B.氢硫酸(H2S的水溶液)是一种弱酸,盐酸是强酸
C.将氯气通入氢硫酸中,溶液中产生黄色浑浊
D.高氯酸在无机含氧酸中酸性最强
③该温度下,SO2的平衡转化率α1=_________,反应的平衡常数K=_________(列式并计算)。
④下列措施中不能进一步提高氯气的平衡转化率的是_________。
A.平衡后将容器的体积压缩为4L B.增大二氧化硫的浓度
C.升高温度 D.将SO2Cl2(g)液化分离
⑤若向该容器中初始投入SO2和Cl2的物质的量均为0.5nmol,则达到平衡时SO2的平衡转化率:α2_________填“>”“<”或“=”)α1。
查看答案和解析>>
科目: 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。下列关于“Na2CO3”的分类错误的是
A.Na2CO3俗名为纯碱,故它属于碱类B.Na2CO3属于化合物
C.Na2CO3属于强电解质D.Na2CO3属于含氧酸盐
查看答案和解析>>
科目: 来源: 题型:
【题目】我国双氧水(蒽醌法)生产厂家每年都会排放一定量的废镍触媒(主要含有金属镍,还含有Fe、Ca、Mg等杂质)。以其为原料制备NiSO4的工艺流程如下:
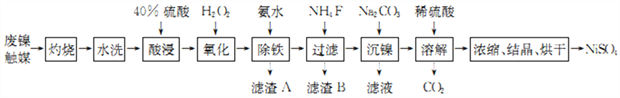
回答下列问题:
(1)废镍触媒灼烧的目的是___________________________。
(2)“酸浸”时,提高镍的浸取率的措施有_________(填字母)。
a.金属镍废料进行“粉碎” b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(3)“氧化”时发生反应的n(Fe2+) ∶n( H2O2) =_________,滤渣B的主要成分的化学式为_________。
(4)已知溶液中c(Fe3+)≤1.0×10-5 mol·L-1 即除铁完全,Ksp[Fe(OH)3]=1×10-39。利用氨水调节溶液pH 可以将铁除去。若测得溶液的pH=3.5,则溶液中的铁是否完全除去? _______________________(列式计算)。
(5)“溶解”过程中反应的离子方程式为_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 淀粉和纤维素都是纯净物
B. 油脂都不能使溴的四氯化碳溶液褪色
C. 蔗糖和淀粉都不能使新制氢氧化铜在加热条件下还原成红色沉淀
D. 羊毛、棉花的主要成分都是蛋白质
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列四图的叙述中,不正确的是



![]()
A. 甲图和丙图分别是生命活动主要承担者和遗传信息携带者的基本单位
B. 乙图小麦种子在晒干过程中所失去的水是自由水
C. 若丙图中a为脱氧核糖,则由b构成的核酸完全水解,得到的化合物最多有5种
D. 在小鼠的体细胞内检测到的化合物丁很可能是乳糖
查看答案和解析>>
科目: 来源: 题型:
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A. HCO3- + H2O ![]() H3O+ + CO32- B. Fe3+ + 3H2O
H3O+ + CO32- B. Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. HS- + H2O ![]() H2S + OH- D. NH4+ + OH-
H2S + OH- D. NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣
B. 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣
C. 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣
D. 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. Fe(SCN)3溶液中加入固体KSCN后颜色变深
D. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________
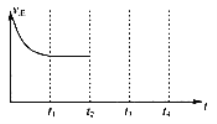
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com