
科目: 来源: 题型:
【题目】已知Br2+2Fe2+===2Fe3++2Br-。向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)为( )
A. 2 B. 4 C. 2.5 D. 6
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得:
2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O +CO2↑。
I.制备碳酸亚铁:装置如图所示。
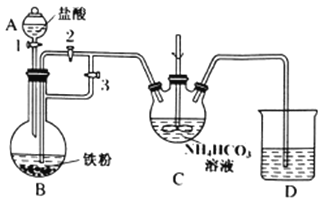
(1)C的名称是___________。
(2)清洗仪器,检查装置气密性,A中加入盐酸,B中加入铁粉,C中加入NH4HCO3溶液。为顺利达成实验目的,上述装置中活塞的打开和关闭顺序为:关闭活塞______,打开活塞______;加入足量盐酸后,关闭活塞1,反应一段时间后,关闭活塞____,打开活塞_____。C中发生的反应的离子方程式为_______________。
Ⅱ.制备乳酸亚铁晶体:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是______________。从所得溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气低温蒸发,________、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其原因可能是_____________________。
(5)经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数 | 0.1000mol/LCe(SO4)2标准溶液体积/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为_________(以质量分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.0200mol/L盐酸分别滴定10.00mL浓度均为0.0200mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
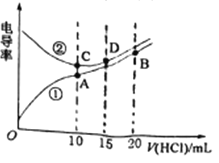
A. 曲线②代表滴定NaOH溶液的曲线,在相同温度下,水的电离程度A>C>D>B
B. 常温下,测得A点溶液的pH=6,则二甲胺常温下电离常数Kb约为10-4
C. 向二甲胺溶液中滴加盐酸10~20mL过程中:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. B点溶液中:c(H+)=c(OH-)+ c[(CH3)2NH2+]+2c[(CH3)2NH·H2O]
查看答案和解析>>
科目: 来源: 题型:
【题目】羟氨(NH2OH)是一种还原剂。将16.00mL 0.05mol/L的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应,生成的Fe2+又恰好被24.00mL 0.02mol/L的酸性KMnO4溶液所氧化。在上述反应中,羟氨的氧化产物为( )
A. NO2 B. NO C. N2O D. N2
查看答案和解析>>
科目: 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol NaOH的溶液恰好完全反应;另取一份加入含b moI HC1的溶液恰好不再放出气体。则该混合溶液中c(Na+)为 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,被誉为“完美电池”,工作原理如图1所示,反应的离子方程式为:VO2++V3++H2O![]() VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法错误的是
VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法错误的是
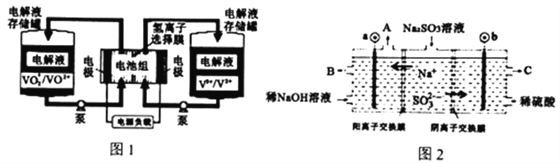
A. 电解Na2SO3溶液时,a极与电池负极相连,图1中H+从电池右边移向左边
B. 电池充电时,正极电极反应为VO2++e-+2H+=VO2++H2O
C. 电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+
D. 若电解过程中图2所有液体进出口密闭,则消耗12.6gNa2SO3,阴极区变化的质量为4.4g
查看答案和解析>>
科目: 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 该物质中所有原子一定共面
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置。
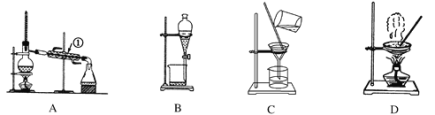
利用以上装置,可以按以下实验方案从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。(已知甲苯和甲醇均为有机溶剂,有机物大多能互溶)

(1)装置A中仪器①的作用是________,使用装置A的操作是_____(填“a”、“b”、“c”或“d”,下同)。
(2)使用装置B的操作是______,为使其中液体顺利滴下,除打开下端活塞外,还应进行的具体操作是___________________。
(3)使用装置C的操作是_______,若所得沉淀不溶于水且需要洗涤,则洗涤的具体操作是________________________________________________________________________________。
(4)使用装置D的操作是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com