
科目: 来源: 题型:
【题目】Na2O2可用作呼吸面罩中的供氧剂,应用于潜艇中。其反应原理是2Na2O2+2CO2=2Na2CO3+O2,该反应中,还原剂是________,氧化剂是________,人体每呼出22.4L CO2气体(标准状况),能够生成_________L氧气(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)0.7 mol H2O的质量为___________。
(5)483gNa2SO4·10H2O中所含的Na+的物质的量是___mol,所含H2O分子的数目是___个。
(6)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(7)a个X原子的总质量为bg,则X的相对原子质量可以表示为___________
(8)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验基本操作(注意事项)中,是基于实验安全考虑的是( )
①加热盛有液体的烧瓶时,需加碎瓷片或沸石
②酒精灯内的酒精不能小于酒精灯容积的三分之一
③实验前,要对气体实验装置进行气密性检査
④稀释浓硫酸时,将浓硫酸沿烧杯内壁慢慢注入水中
⑤实验结束后,清洗后的洁净试管,要倒放在试管架上
A. ①②③④⑤ B. ①②④ C. ②③④ D. ②③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是:
A. Fe的摩尔质量为56g/mol
B. 通常状况下,18g水中含有1mol水分子
C. 0.1mol/L NaCl溶液中含Na+的物质的量为0.1mol
D. 标准状况下,11.2L O2与N2的混合气中含有的分子个数为3.01×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 阿伏加德罗常数是12g碳中所含有的碳原子数
B. 已知微粒个数,可通过阿伏加德罗常数计算出微粒的物质的量
C. 阿伏加德罗常数的数值是6.02×1023
D. 阿伏加德罗常数的符号为NA,通常用6.02×1023表示
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
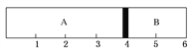
(1)A室混合气体所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氢气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。

(5)钴的一种化合物晶胞结构如下图所示。
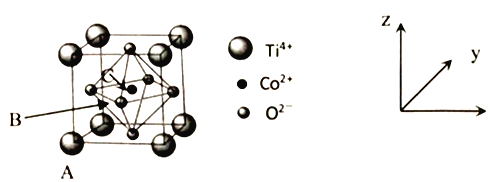
①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
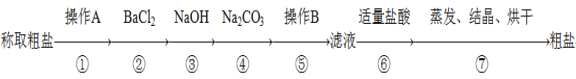
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)______________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________。
(4)判断BaCl2已过量的方法是____________________________________。
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验_____离子,应先加入过量的_____________________。
②将所得混合物______(填操作名称),然后在溶液中加入试剂________检验另一离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com