
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某次实验中预计需要使用480mLamol/L的纯碱溶液,下面是某同学在实验室配制该溶液的流程图,回答下列问题:
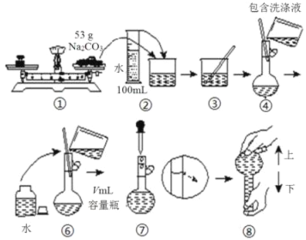
(1)流程图中的配制过程少了第⑤步,请指出缺少的步骤内容是_____________________________
(2)所选容量瓶最合适的v值为____________,根据图示的相关数据,可求出a=__________.容量瓶在使用之前必须进行的一项操作是________________________。
(3)所给出的流程图中体现出的操作内容有三个明显错误(其中不包括缺少的第⑤步),请写出:
①__________________________②________________________③__________________________。
(4)指出下列实验操作对结果以及对所配制溶液浓度的影响,填写“偏大”“偏小”或者“无影响”.
①溶解后,没有洗涤玻璃棒以及烧杯:_________________
②定容时俯视刻度线:_________________
③未经冷却趁热将溶液注入容量瓶中______________
④容量瓶洗涤后,未经干燥处理_______________
⑤摇匀后发现液面低于刻度线继续加水定容______________
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】某高中化学兴趣小组设计合成高分子材料

已知:
①A的相对分子质量为92;
②根据结构分析得知同一碳原子上连接两个羟基时结构不稳定,易脱水生成醛或酮;
③D可与新制的氢氧化铜反应;
回答下列问题:
(1)A的结构简式为:___________,B的名称为___________,由B生成C的反应类型是:___________。
(2) 由C生成D的化学方程式为:____________________________,反应过程中生成不稳定的中间产物结构简式为:___________。
(3)写出D转化为E的流程示意图:___________ (示例![]() )
)
(4)E合成高分子材料的化学反应方程式:_________________________________。
(5)E的同分异构体中,满足下列条件的有___________种。
①仅含有苯环,无其他环状结构;
②苯环上只有两个取代基;
③能使三氯化铁溶液显紫色;
④ 含有![]() 的结构;
的结构;
其中核磁共振氢谱表明分子中有六种氢,能发生银镜反应且其峰面积之比为2∶2∶2∶2∶1∶1
请写出其结构简式为:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代在西汉《淮南子·万毕术》一书中有湿法炼铜的文字记载:“曾青得铁则化铜”铜金属被广泛地应用于电力、电子、交通、轻工、新兴产业等领域。
回答下列问题:
(1)铁原子的外围电子排布图为___________。
(2)向FeCl3溶液加入KSCN溶液形成K3[Fe(SCN)6]血红色溶液。
①写出与SCN-离子互为等电子体的合理分子或离子:_____________。(两个)
②铁原子的堆积方式如右图(甲)所示,其晶胞特征如右图(乙)所示,原子之间相互位置关系的平面图如右图(丙)所示;已知铁原子半径rpm,铁晶胞空间利用率为:____________。(用字母π表示)

(3)含有Fe2+的水溶液可以用K3[Fe(CN)6]于实验室的定性检验,检验Fe2+离子的离子方程式为:___________。
(4)一水合硫酸四氨合铜[Cu(NH3)4]SO4·H2O为蓝色正交晶体,常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。
①[Cu(NH3)4]SO4·H2O中非金属元素H、N、O的电负性由大到小的顺序为:___________。(用元素符号作答)
②[Cu(NH3)4]SO4·H2O晶体中存在的化学键有___________ (填编号)
a金属键 b离子键 c氢键 d配位键 e极性键 f非极性键
③NH3分子的VSEPR模型为:___________;SO42-中S为___________杂化。
(5)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为acm,则该氧化物的密度为______g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )

A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】氯及其化合物在工农业生产和日常生活中有着广泛的用途。
Ⅰ.实验室用下图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃~5℃、强碱性溶液中比较稳定。

(1)装置A中的玻璃仪器的名称分别是___________。
(2)装置A中KMnO4与盐酸反应生成KCl、MnCl2和Cl2,其离子方程式为_______________________。将制备的Cl2通过装置B可除去___________ (填化学式)。
(3)Cl2和KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________________。
Ⅱ.某学习小组用下图装置制取并收集ClO2。(已知无水草酸在100℃可以升华)
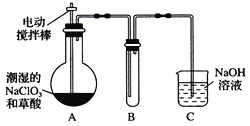
(1)实验时装置A需在60℃~100℃进行的原因是_________________________。
(2)电动搅拌棒的作用是_______________________。
(3)装置A中反应产物有Na2CO3、ClO2和CO2等,用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根高子(ClO2-)。

①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示
②当pH≤2.0时,写出ClO2被I-还原的离子方程式________________________________。
③当pH为7.0~8.0时,ClO2的还原产物为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A. x的值为2 B. A的转化率为60%
C. B的平衡浓度为0.8 mol/L D. D的体积分数为25%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. Fe(SCN)3溶液中加入固体KSCN后颜色变深
D. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com