
科目: 来源: 题型:
【题目】有机物G是一种常用的植物调味油,工业上可按如下路线合成。
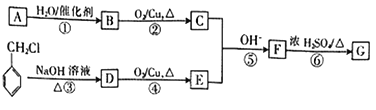
已知:
①有机物A是分子中单键与双键数目之比为4∶1的烯烃;
②G的分子式为C9H8O,能发生银镜反应;
③CH3CHO+CH3CHO![]()
![]() 。
。
回答下列问题:
(1)B的名称为__________,F中含有的官能团的名称是__________。
(2)E的结构简式为__________,G的结构简式为________________。
(3)⑤的反应类型为__________,⑥的反应类型为__________。
(4)反成③的化学方程式为_____________________________。
(5)反应①~⑥中符合原子经济性(原子利用率为100%)的是__________ (填序号)。
(6)同时符合下列条件的F的同分异构体有__________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3∶3∶2∶2的是__________ (填结构简式)。
a.苯环上含有两个取代基 b.分子中含有-COO-结构
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是


①用图 1所示装置从 Fe(OH)3 胶体中过滤出 Fe(OH)3 胶粒
②用图 2所示装置从氯化钠溶液中得到氯化钠晶体
③用图 3所示装置从溴的四氯化碳溶液中分离出四氯化碳
④用图 4所示装置从 C2H5OH 与苯的混合物中分离出苯
⑤用图 5 装置灼烧海带
A. ①②⑤ B. ②③④⑤ C. ②⑤ D. ①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法错误的是( )
A. 标准状况下,22.4L 由 N2 和 N2O 组成的混合气体中,所含有的氦原子的物质的量为 2mol
B. 1.7g NH3 含有的质子数为 NA
C. 标准状况下,11.2L 氦气和氢气的混合气含有的分子数为 0.5NA
D. 1L 0.1mol/LCH3CH2OH 水溶液中含 H 原子数目为 0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________,其中未成对电子数为____________。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________。ZnGeAs2中Zn、Ge、As的电负性从大到小的顺序为________________。
(3)聚吡咯的单体为吡咯(![]() ),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
),该分子中氮原子的杂化轨道类型为__________;分子中σ键与π键的数目之比为________________。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
立方碳化硅 | 晶体硅 | 金刚石 | |
熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:__________________________________________________。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。
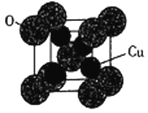
①氧化亚铜属于__________晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表:
分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 500g·L-1 |
合成过氧化尿素的步骤及反应器的示意图如下:在250mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2h,得过氧化尿素产品。回答下列问题:

(1)控制反应温度的适宜方法是__________ (填序号)。
A.酒精灯加热 B.酒精喷灯加热 C.电炉加热 D.水浴加热
(2)反应器中发生反应的化学方程式为___________________________________。
(3)反应器中冷凝管中冷水从______(填“a”或“b”)流进;反应器加热温度不能太高的原因是___________。
(4)搅拌器不能选择铁质或铝质材料的原因是_______________________________________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
实验序号 | 1 | 2 | 3 | |
KMnO4溶液体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
滴定后读数 | 19.98 | 21.70 | 22.02 | |
①KMnO4溶液应盛放在__________滴定管中,滴定终点的现象是_____________。
②产品中活性氧的质量分数为____________。
③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量__________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】假设一个蛋白质分子是由二条肽链共500个氨基酸分子组成,则此蛋白质分子中-COOH数目至少为( )
A. 2个 B. 501个 C. 502个 D. 1个
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸盐和金属硫化物在工农业生产中有广泛的应用。
(1)已知:
反应Ⅰ:CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
反应 Ⅲ:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) (B) △H3
①△H3=__________。
②能使反应Ⅰ、Ⅱ速率加快的措施有____________________________________(写出两条)。
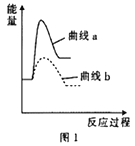
③已知某温度下反应Ⅰ的反应速率小于反应Ⅱ的反应速率,则图1中曲线a表示__________ (填“反应Ⅰ”或“反应Ⅱ”)。
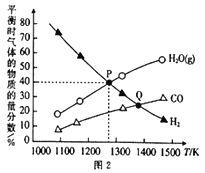
(2)在2L密闭容器中,加入0.1molMoS2(硫化钼)、0.2molNa2CO3和0.4molH2,发生反应MoS2(s)+2Na2CO3 (s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
①反应速率:P点______ Q点(填“<” “>”或“=”),其判断理由是_____________。
②气体总压:P点__Q点(填“<” “>”或“=”),其判断理由是_____________。
③P点对应温度下,H2的平衡转化率为__________,平衡常数K=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中所列出的物质 , 属于 贴错了标签的是( )
选项 | A | B | C | D |
物质的化学式 | HNO3(浓) | 乙醇 | P4 | CCl4 |
危险警告标签 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】现有34 g 某气体,它的摩尔质量为17g.mol-1。则:
(1)该气体为_____________mol
(2)该气体所含分子数为_________ NA
(3)该气体在标准状况下的体积为_________ L
(4) ________g H2O中的氧原子数目与保准状况22.4LCO2中的氧原子数目相同。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com