
科目: 来源: 题型:
【题目】下列说法不正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 原电池中发生的反应达到平衡时,该电池无电流产生
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇. 某化学兴趣小组对亚硝酸钠进行多角度探究:
i.亚硝酸钠的制备
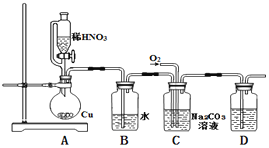
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____.
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______________。
ii. 探究亚硝酸钠与硫酸反应气体产物成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃

(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________.
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、______、______、______.
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是_________________.
②装置B的作用是____________________.
iii. 设计实验证明酸性条件下NaNO2具有氧化性:___________。
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.米饭在咀嚼时产生甜味的原因是淀粉的水解
C.油脂是人体必需的营养物质之一
D.工业上常利用蛋白质的水解反应来制取肥皂
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.5mol C2H2O4的质量是_______g,约含______个C2H2O4分子,含______mol氧原子。
(2)38.4g SO2在标准状况下的体积为___________L,该气体在标准状况下的密度是______________。
(3)在标准状况下,将_______L NH3溶于水得到0.5 mol·L-1的氨水250 mL;配制100 mL 0.2 mol·L-1CuSO4溶液,需要CuSO4·5H2O________g。
(4)液态化合物XY2在一定量O2中恰好完全燃烧(XY2(液)+ 3O2(气)= XO2(气)+ 2YO2(气)),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是___________mL。 ②化合物XY2的摩尔质量是___________。
③若XY2分子中X、Y两元素的质量之比为3:16,则X、Y两元素分别是_________和________。(写元素符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液。右图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后列式计算(要求写出计算过程):

(1)该溶液的物质的量浓度为_________ mol·L-1(结果保留2位有效数字);
(2)该溶液的密度为__________ g·mL-1;
(3)如果从该瓶中取出75g葡萄糖注射液,将其变为15%的注射液,需要加入______g葡萄糖固体(质量精确到0.1g)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.氯化钠可用于制备纯碱
B.食品袋中常放有生石灰,能起到抗氧化剂的作用
C.大力发展新能源汽车能减少酸雨危害
D.石油裂化、煤的干馏、玉米制乙醇、蛋白质变性都属于化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】
以有机物A 合成聚酯类高分子化合物F 的路线如下:

已知: 
(1) A生成B 的反应类型为_________,C 中官能团的名称为__________ 。
(2) D 与NaOH 水溶液反应的化学方程式为__________ 。
(3) ①E 生成F 的化学方程式为__________。
②若F的平均相对分子质量为20000,则其平均聚合度为________ (填选项字母)。
A.54 B.108 C.119 D.133
(4) E 在一定条件下还可以合成含有六元环结构的G,G 的结构简式为__________。
(5) 满足下列条件的C 的同分异构体有___种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4 个碳原子上各连有一个取代基
②1mol 该物质与新制氢氧化铜悬浊液反应产生2mol 砖红色沉淀
(6) 写出以![]() 为原料(其他试剂任选) 制备化合物
为原料(其他试剂任选) 制备化合物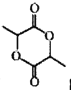 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示:  。___________________。
。___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知: ![]()
![]()
则CO还原Fe2O3(s)的热化学方程式为________________________________。
(2)常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下:NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)______c(HCO3-)(填“>”“<”或“=”),计算反应NH4+ + HCO3- + H2O NH3·H2O + H2CO3的平衡常数K=______________,物料守恒表达式为__________________________。
(3)以CO2为原料还可以合成多种物质。
①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在_______处向饱和NaCl溶液中通入_________气体(填NH3或CO2),然后再在通入另一种气体。请写出反应的化学方程式_______________________。
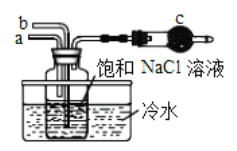
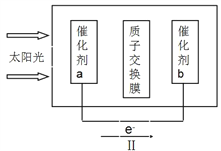
②人工光合作用能够借助太阳能用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com