
科目: 来源: 题型:
【题目】下图是某水溶液常温下pH从0到14的范围内H2CO3、HCO3-、CO32-三种成分平衡时组成分数,下列叙述正确的是
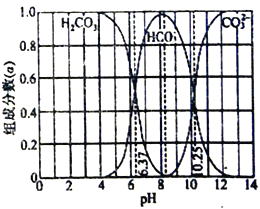
A. 此图是1.0mol/L碳酸钠溶液滴定1.0mol/L盐酸的滴定曲线
B. 向pH=10.25的溶液中通HCl气体使pH=7,此时c(H2CO3)>c(Cl-)=c(HCO3-)>c(CO32-)
C. 人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D. 该温度下,碳酸氢根的水解平衡常数Kh=10-3.75
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生欲用0.100 0 mol·L-1的盐酸来滴定未知浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用0.100 0 mol·L-1的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到因加入一滴盐酸后,溶液由红色变为无色,且____________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为____________mL,终点读数为____________mL。

(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 氢氧化钠溶液/mL | 0.100 0 mol·L-1 盐酸的体积(mL) | ||
滴定前 | 滴定后 | 消耗 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准状况下有以下四种气体:
①6.72 L CH4 ②3.01×1023个HCl分子 ③2.404×1023个H2S分子 ④0.2 mol NH3
a.物质的量由小到大的顺序_____________________________________
b.质量由小到大的顺序_________________________________________
(2)12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
(3)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中:混合气体的平均相对分子质量是________,对氢气的相对密度是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对于有机物![]() 的叙述正确的是
的叙述正确的是
A. 在一定条件下1mol该物质最多与4molH2发生加成反应
B. 该物质不能与碳酸氢钠反应放出二氧化碳
C. lmol该物质与足量的金属钠反应生成2molH2
D. 该物质含羟基与苯环直接相连的结构且能水解的同分异构体有19种
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA
B. 3.6g重水中含有的中子数为2 NA
C. 常温下,1L1mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
D. 一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成.回答下列问题:

(1)B和A为同系物,B的结构简式为 .
(2)反应①的化学方程式为 ,其反应类型为 .
(3)反应③的反应类型为 .
(4)C的结构简式为 .
(5)反应②的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶上的有关数据,该浓盐酸中HCl的物质的量浓度为________mol/L。某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸:

(2)该学生需要量取_______mL上述浓盐酸进行配制。
(3)配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是(填写名称)_______、_______。
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)_____________________;
A.用30mL蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1~2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是_____________________
A.摇匀后静置,发现液面低于刻度线,继续加水至与刻度线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________________。
(4)判断BaCl2已过量的方法是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是( )

A. 实验Ⅰ:实验室制备氨气 B. 实验Ⅱ:用二氧化碳作喷泉实验
C. 实验Ⅲ:进行中和热的测定 D. 实验Ⅳ:电解氯化铜溶液得到铜和氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com