
科目: 来源: 题型:
【题目】下列叙述正确的是
A.酸性:H2SO4 > HClO4B.半径:r(Na+) > r(S2-)
C.稳定性:PH3 < H2OD.碱性:Ba(OH)2 < Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中不正确的是
A. 量取100 mL,该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有29.25 g NaCl
C. 配制100 mL该溶液,用托盘天平称5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1∶2置于恒容密闭容器中,发生如下反应:
NO2(g)+SO2(B)![]() NO(g)+SO3(g)△H=-41.8kJ·mol-1,能说明反应达到平衡状态的是( )
NO(g)+SO3(g)△H=-41.8kJ·mol-1,能说明反应达到平衡状态的是( )
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. NO和SO3的物质的量之比保持不变 D. 每消耗1molNO2的同时生成1molSO3
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目: 来源: 题型:
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49 kJmol-1
CO2(g)+3H2(g) △H=+49 kJmol-1
副反应:H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=+41 kJmol-1
CO(g)+H2O(g) △H=+41 kJmol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_________________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处_________________________。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
0.05 | C1 | 4.8 |
c2 | C1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl_____P2(填“大于”或“小于”)温度T3_______T4(填“大于”或“小于”);压强为P1时,在N点; v正_______v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数 K=_____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在密闭容器中充入4moIX,当反应4X(g)3Y(g)+Z(g)达到平衡状态时,有30%的X发生分解,则达到平衡状态时混合气体的总物质的量是( )
A.4mol
B.3.4mol
C.2.8mol
D.1.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状态下,将11.2 LHCl气体溶于水,制成250mL溶液。
(1)试求该盐酸溶液的物质的量浓度______;
(2)如果用质量分数为36.5%密度为1.2 g/cm3 的浓盐酸来配制上述溶液,则应量取该浓盐酸多少毫升进行稀释____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是___________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)____(填“>”“<”或“=”)0.1 mol·L-1的NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= __________mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断室温下(NH4)2CO3溶液的pH____(填“>”“<”或“=”)7。
(5)将相同温度下相同浓度的以下四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列_____________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种磁性材料的磨削废料(含镍质量分数约21%) 主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制各纯度较高的氢氧化镍,工艺流程如下: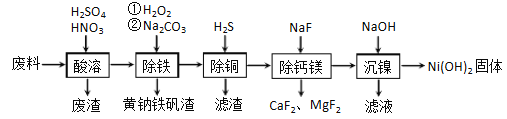
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成.写出金属镍溶解的离子方程式________________________________________。
(2)“除铁”时H2O2的作用是____________,为了证明添加的H2O2已足量,应选择的试剂是_____________(用化学式表示)溶液。黄钠铁矾[NaFe3(SO4)2(OH)6]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,此步骤加入碳酸钠的目的是_________________________。
(3)“除铜”时,反应的离子方程式为_________________________,若用Na2S代替H2S除铜,优点是_________________________。
(4)已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程中Ni(OH)2 生成时,调节pH 约为________Ni2+刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,认为该离子沉淀完全: lg2=0.30)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com