
科目: 来源: 题型:
【题目】(1)写出下列物质在水中的电离方程式:
①Ba(OH)2:________________________________________________;
②KAl(SO4)2:____________________________________________。
(2)写出下列物质发生水解的离子方程式:
①NaClO:________________________________________________________;
②FeCl3:_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,用0.1000 mol·L-1NaOH溶液滴定20. 00 mL 0.1000 mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c( H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)> c( CH3COO-) >c( H+)
D. 滴定过程中会出现:c(CH3COOH)>c( CH3COO-)>c(H+) >c( Na+)>c( OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子能在呈酸性的无色溶液中大量共存的是( )
A.Ba2+、Na+、NO3-、MnO4-B.Mg2+、Cl-、Al3+、SO42-
C.K+、Cl-、I-、NO3-D.Ca2+、Na+、Fe3+、SO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔是物质的量的单位
B. 溶液中或熔融状态下能导电的物质就是电解质
C. 氧化还原反应的本质是元素化合价发生了变化
D. 得电子的物质被还原,是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】运用基本公式进行计算:
(1)标准状况下,①4g氢气、 ②33.6L甲烷(CH4)、 ③6.02×1024个水分子、④1mol NH3中,
分子数由大到小的顺序为 ____________________(填序号,下同),含氢原子数最多的是_________,体积最大的是____________。
(2)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(混合后体积变化忽略不计),
所得溶液中Cl-的物质的量浓度是_____________________。
(3)已知224L标准状况下的HCl气体完全溶于1L水(密度为1g/cm3)得到密度为1.1g/cm3的盐酸,此盐酸的物质的量浓度为:__________________ (保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用H2S废气制取H2的方法有利于环保。
(l) H2S的电子式是____,H2S溶液中H2S、HS-,S2-的物质的量分数δ(X)随pH的变化如图所示,H2S的电离平衡常数ka1= ___________
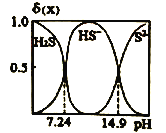
![]()
(2)利用H2S废气制取H2的方法有多种。
①热化学硫碘循环法 已知循环反应如下:
H2S(g)+ H2SO4(aq)═S(s)+ SO2(g)+2 H2O(l)△H1=61 kJ/mol
SO2(g)+I2(g)+2 H2O(l)=2HI(aq)+ H2SO4(aq)△H2=-151 kJ/mol
2HI(aq)= H2(g)+ I2(g)△H3=110kJ/mol
写出硫化氢气体分解为氢气和固体硫的热化学方程式_____。
②高温热分解法
已知:H2S (g) =H2(g)+l/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为cmol/L,测定H2S的转化率,H2S的平衡转化率与温度关系如图所示。据图可知:温度升高平衡常数K_______(填“增大”、“减小”或“不变”)。若985℃时平衡常数K=0.04,则起始浓度c= ______mol/L 。
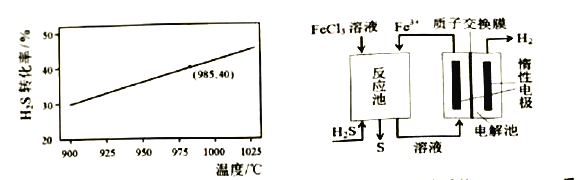
③电化学法 该法制氢过程的示意图如上图。循环利用的物质是____。反应池中化学反应方程式为______。电解池阳极电极反应式为____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图1、2、3为三套实验装置。
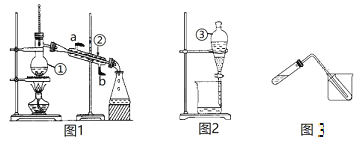
(1)图中所示仪器①和③的名称分别是_____________、_____________。
(2)图1装置可用于少量蒸馏水的制取,需要在仪器①中加入碎瓷片,目的是___________________;仪器②中冷却水的入口是__________(填“a”或“b”);图3装置也可用于少量蒸馏水的制取(加热及固定仪器略),该装置中使用的玻璃导管较长,其作用是____________。
(3)若用CCl4从碘水中萃取I2并用图2装置进行分离,振荡后静置观察到的现象是___________________________________________________________;在用图2装置进行分液操作时,为使液体顺利滴下,应进行的具体操作是_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Co3O4是制备石墨烯电池正极材料LiCoO2的原料。以钴矿石(主要成分为Co3S4,含有少量FeO、Fe2O3、Al2O3等杂质)为原料制取Co3O4的工艺流程如下:
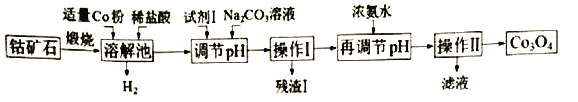
已知:Co与Fe为活泼金属,氧化性由强到弱的顺序为:Co3+>Fe3+>Co2+。
几种氢氧化物的溶度积如下表:
![]()
(l)写出溶解池中生成H2的离子反应方程式是____。
(2)加入试剂1的目的是将Fe2+氧化为Fe3+.试剂l可选用__ 。
A.氯化钠 B.双氧水 C.亚硫酸钠 D.碘水
(3)残渣l的主要成分为____。用浓氨水再调节pH,pH应略大于___ 。(已知:lg2=0.3.当离子浓度小于l.0×l0-5mol/L,可认为沉淀完全)。
(4)操怍Ⅱ包括____、____、干燥,灼烧四个步骤;灼烧中反应的化学方程式 _________。
(5)要得到15.0g质量分数为98%的LiCoO2正极材料,理论上需要Co3O4的质量为 __________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com