
科目: 来源: 题型:
【题目】下图甲是人体细胞化合物含量的扇形图,图乙为人体内组成染色体的两种重要化合物A与C的化学组成关系,据图分析回答:

(1)若图甲表示细胞鲜重,则①化合物是_______,若图甲表示细胞干重,则①化合物是________,它在图乙中的物质是_______(用字母表示)。
(2)图乙中b分子通过______方式形成B,连接两个b分子的化学键叫做_______,若用结构式表示应为__________。
(3)在图乙中,a和b两种化合物其它的组成元素分别是_______、_______,化合物单体a的名称是________________。
(4)我们知道人的红细胞和心肌细胞的主要成分都是蛋白质,但这两种细胞的功能却完全不同,请你从蛋白质的结构方面做出解释_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某蛋白质由三条肽链构成,其结构示意图如下,其中“—S—S—”为由两个“一SH”构成的二硫键,其作用是连接两相邻肽链。若该蛋白质分子共由A个氨基酸组成,则形成一个该蛋白质分子时减少的相对分子质量为:

A. 18(A-3)+4 B. 18(A-2)+4
C. 18m(A-3) D. 18(A-2)
查看答案和解析>>
科目: 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是______________________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是(用离子方程式说明)___________。
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如下图所示。
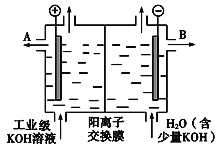
①该电解槽的阳极反应式是_______________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因____________________________。
③除去杂质后的氢氧化钾溶液从液体出口______(填写“A”或“B”)导出。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列溶液中微粒浓度关系一定正确的是
A. 0.1molLNa2CO3溶液,加水稀释,c(HCO3-)/c(CO32-)减小
B. pH=7的氨水与氯化氨的混合溶液中:c(Cl-)>c(NH4+)
C. 0.1molL的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
D. pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeSO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。
【答案】红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)3淡黄色固体向内NaOHNO3NO2+H2O = 2HNO3+NO黄绿色变为无色5
【解析】
+2价的铁离子易被氧气氧化成+3价的铁离子,NH3与FeSO4溶液的水反应生成Fe(OH)2沉淀,Fe(OH)2沉淀易被空气中的氧气氧化;H2S和SO2反应生成单质硫和水,过量的SO2用碱吸收;NO2与水反应生成硝酸和一氧化氮;氯气的颜色为黄绿色,氨气与氯气发生氧化还原反应生成氮气和氯化氢,3Cl2+2NH3═N2+6HCl,过量的氨气与产物氯化氢反应生成氯化铵。
(1)氨气溶于水得到氨水,反应的化学方程式为:NH3+H2ONH3H2O,氨水与硫酸亚铁溶液反应生成氢氧化亚铁白色沉淀,反应的化学方程式为:FeSO4+2NH3H2O═Fe(OH)2↓+(NH4)2SO4,Fe(OH)2白色沉淀,在空气中易被空气中的氧气氧化,迅速变成灰绿色,最终变为红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3。(2)15mLH2S和10mLSO2反应2H2S+SO2=3S+2H2O,反应产生固体硫和液态水,SO2过量,针筒内压强减小,活塞自动向内移动,析出浅黄色固体,过量的SO2用NaOH溶液吸收。(3)二氧化氮气体溶于水,与水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO,由方程式可知可知30 mLNO2生成10mL无色的NO气体。(4)氯气的颜色为黄绿色,氨气与氯气发生氧化还原反应生成氮气和氯化氢,气体颜色变浅,反应的化学方程式为:3Cl2span>+2NH3═N2+6HCl,由方程式可知,15 mLCl2消耗10ml氨气、生成30ml氯化氢,过量的氨气与氯化氢恰好反应生成氯化铵,反应中有大量的白烟产生。
【点睛】
该题主要考查了元素及其化合物的知识,涉及氮、氯、硫的化合物的性质,注意根据化合物的性质认识理解化学反应,正确分析实验现象。
【题型】填空题
【结束】
30
【题目】有一瓶硫酸和硝酸的混合溶液(1)取出10.00mL该溶液,加入足量BaCl2溶液,过滤、洗涤、干燥得4.66g沉淀。滤液跟40 mL 2.00mol/L的NaOH溶液恰好反应使溶液呈中性,则混合液中硫酸和硝酸的物质的量浓度分别为多少____?(2)取出20.00mL该溶液,加入足量Cu粉,若氧化产物只有NO,可产生NO的物质的量是多少____ ?
查看答案和解析>>
科目: 来源: 题型:
【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
【答案】H+、Ba2+、I-、NH4+ CO32-、SO42-、Mg2+、Fe3+
【解析】
由(1)知溶液中存在H+离子,无CO32-离子;由(2)知溶液中存在I-离子、无Fe3+离子;由(3)知溶液中无Mg2+离子;由(4)知溶液中有Ba2+离子,无SO42-离子;由(5)知溶液中存在NH4+离子。综上可知溶液中一定含有的离子为H+、NH4+、Ba2+、I-,一定不含有的离子为CO32-、Mg2+、Fe3+、SO42-,可能含有的离子为Na+、K+、Cl-。
【点睛】
本题考查了常见的离子检验方法,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析。
【题型】填空题
【结束】
28
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示的实验装置进行电化学实验,下列判断正确的是( )
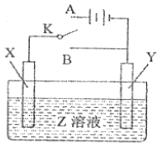
A. 若X为铝片,Y为镁片,Z为NaOH,将开关K置于B处则Y为原电池的负极
B. 若X为铜片,Y为铁片,Z为CuSO4,将开关K置于A处可实现在铁片上镀铜
C. 若X为铁片,Y为锌片,Z为NaCl,将开关K置于A或B处均可减缓铁的腐蚀
D. 若X、Y均为碳棒,Z为NaOH,将开关K置于A处,Y极发生的反应为2H++2e-=H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com