
科目: 来源: 题型:
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
d | 位于周期表中第7纵列 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)c属于_____________区的元素,其基态原子的电子排布图为________________________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为______________(用元素符号表示)。
(3)元素b 的氢化物的水溶液中存在的氢键有_______种;画出一种存在于b 的氢化物与水分子之间的氢键________________________________。
(4)a与其同主族短周期元素的最高价氧化物的熔点高低顺序为___________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为_____________,A的空间构型为____________________;
(5)a元素与b元素可形成ab-阴离子,则与ab-互为等电了体的单质及化合物的化学式分别为_____________、______________(各填写一种)。
(6)在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为________________。
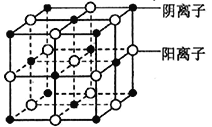
(7)d 的某氧化物晶体结构如图。每个阴离子周围等距离且最远的阴离子数为_______________,其晶胞的棱长为xcm,则该晶体距离最近的两个阴离了的核间距为_________cm (用含有x 的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,其性质活泼,具有强还原性,是常用的食品抗氧化剂之一。制备该物质的反应方程式为: Na2SO3+SO2= Na2S2O5,某研究小组利用该反应在实验室制备焦亚硫酸钠并探究其有关性质。请回答下列问题:
(1)采用下图装置制取Na2S2O5,装置Ⅲ中有Na2S2O5晶体析出。
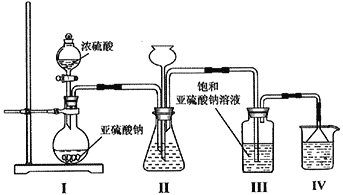
①装置Ⅰ中盛放浓硫酸的仪器名称为__________;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是___________________________________。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择____________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是_______________;裝置Ⅳ的作用是_________________________,盛装的试剂为_____________________。
(2)将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。
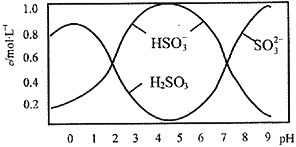
①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式_____________________;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因_____________________________。
(3)检验Na2S2O5晶体在空气中已被氧化的实验方案是_________________________。
(4)葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:
![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为___g·L-1,该数据说明某葡萄酒中SO2的残留量_________ (填“是”或“否”)达到我国国家标准。
查看答案和解析>>
科目: 来源: 题型:
【题目】同主族常见的三种元素 X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为:HXO4<HYO4<HZO4 , 下列判断不正确的是( )
A.Y 单质可以在海水中提取
B.单质氧化性:Y>Z
C.气态氢化物稳定性:HX<HZ
D.离子半径:X﹣>Y﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法不正确的是()

A. 蒸馏烧瓶中加入沸石的目的是防止暴沸
B. 蒸馏海水获得蒸馏水可以不用温度计
C. 冷凝水从冷凝器的下口流入,上口流出
D. 该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】关于氨的下列叙述中,不正确的是( )
A.液氨是纯净物
B.NH3的催化氧化可用于制取硝酸
C.氨易液化,因此可用来作制冷剂
D.实验室常用湿润的蓝色石蕊试纸检验氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下图是元素周期表中的一格,从中获取的信息不正确的是( )

A. 该元素的元素符号为Ar
B. 该元素属于金属元素
C. 该元素的原子核外有18个电子
D. 该元素的相对原子质量为39.95
查看答案和解析>>
科目: 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠保存不当容易变质,某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置发生反应的化学方程式:
装置A:___________________________。
装置B:___________________________。
装置C:____________________________。
(2)NaOH溶液的作用是_________________________。
(3)为准确读出氧气的体积需以下操作,正确的顺序为_________。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
读出量筒内水的体积后,折算成标准状况氧气的体积为1.12L,则样品中过氧化钠的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com