
科目: 来源: 题型:
【题目】已知:在常温下,苯(C6H6)为一种无色、透明的液体,毒性较高,易挥发,易燃,有腐蚀性,沸点为80.1℃,难溶于水,易溶于有机溶剂,可作为有机溶剂;碘(I2)为紫黑色晶体,易升华,易凝华,熔点113.5℃,沸点184.3℃,加热时碘升华为紫色蒸气,冷却后凝华成紫黑色固体。实验室常用苯来提取碘水中的碘,具体操作如下:

①向碘的水溶液中加入萃取剂苯,转移到分液漏斗中,塞上玻璃塞,充分振荡放气后(如图1);
②将分液漏斗置于铁架台的铁圈上静置(如图2);
③当分液漏斗中的液体分成清晰的两层后,经“合适的操作”将两层液体进行分离;
④将分离出的碘和苯的混合液转移到仪器A中,加入少量沸石进行蒸馏以分离苯和碘(如图3)。
请回答下列问题:
(1)分液漏斗在使用前必须进行的操作是_______。
(2)步骤③中“合适的操作”的名称是________。
(3)步骤④中采用水浴加热而不直接加热的原因是________________;图3中有多处明显的错误:a.冷却水进出方向错误.b.___________________。
(4)锥形瓶置于冰水中的目的是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______.
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH____7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,c(OH-)=_________。
(3)向2份0.1mol/LCH3COONa溶液中分别加人少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为_____、______ (填“减小”“增大”或“不变”)。
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴阳离子总浓度大小, NaA_______NaB (填">”、“<”或“=")。
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+沉淀完全的pH为____。(Ksp[Fe(OH)3]=4×10-38,1g2=0.3)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0达到平衡后,试回答下列问题:
2NH3(g)ΔH<0达到平衡后,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=______;若降低温度,K值将______(填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
(3)达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图所示。下列说法正确的是_______ (填序号)。
a.图I可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅱ可能是不同温度对反应的影响,且T1>T2
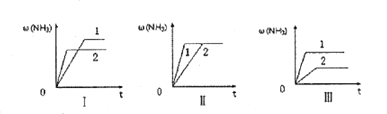
(5)A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x____y(“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是重要的化工原料,甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,工业上称为“甲烷蒸气转化法”。
(1)已知有关反应的能量变化如下图:
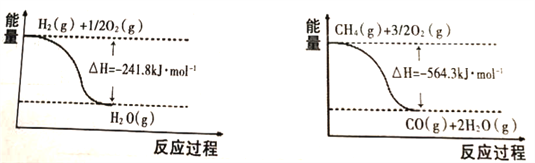
则甲烷和水蒸气反应生成一氧化碳和氢气的热化学方程式为_______________________________;
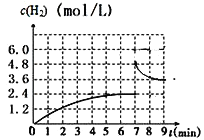
(2)已若该反应在700℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,反应中氢气浓度随时间的变化如右图,6min达到平衡。该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。由第一次平衡到第二次平衡,平衡移动的方向是_____________,采取的措施可能是___________________。
(3)右图中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________(填字母)。
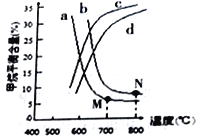
在实际生产中采用图中M点而不是N 点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.金属钠着火时,用细沙覆盖灭火
B.化学危险品标志上的数字表示的是危险等级
C.蒸馏实验结束后,先停止通冷凝水,再停止加热
D.焰色实验所用的铂丝,每次用完后都要用蒸馏水洗涤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】反应条件是影响有机化学反应的重要因素。下列各组物质的反应产物与反应条件无关的是( )
A. 甲苯与溴
B. 丙烯与溴的CCl4溶液
C. 溴乙烷与氢氧化钠溶液
D. 乙醇与氧气
查看答案和解析>>
科目: 来源: 题型:
【题目】广泛用于纺织工业的连二亚硫酸钠(Na2S2O4),俗称保险粉,是一种强还原剂,可溶于水,但不溶于乙醇,在碱性介质中稳定。
Ⅰ.工业上制备连二亚硫酸钠的流程如下:

请回答下列问题:
(1)步骤①中的化学方程式为___________________________________;
(2)步骤②中沉淀为_________________________________(填化学式);
(3)步骤③中加入NaCl 固体的作用是______________________________,分离出保险粉方法为_______、洗涤、干燥,洗涤所用试剂是___________________________。
Ⅱ.工业上也可用右图装置电解NaHSO3溶液制Na2S2O4。
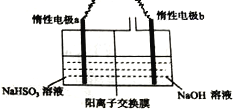
(1)惰性电极a连接电源的_________(填“正极”或“负极”),其电极反应式为________________;
(2)若不加隔膜,则得不到连二亚硫酸钠,其原因是____________________________。
Ⅲ.探究Na2S2O4的性质:
某课题小组常温下测定0.050 molL-1Na2S2O4溶液在空气中的pH变化如下图所示;
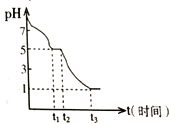
(1)0-t1段主要生成HSO3-,根据pH变化图,写出0- t1发生反应的离子方程式为______________;
(2)若t1时溶液中Na2S2O4全部被氧化成NaHSO3,此时溶液中c(SO32-)-c(H2SO3) =__________ molL-1(填具体数值,不考虑溶液体积变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】在250mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。取此溶液20mL,用水稀释至100 mL,稀释后该硫酸盐的物质的量浓度为
A.2 mol·L﹣1 B.0.4 mol·L﹣1 C.0.8 mol·L﹣1 D.1.2mol·L﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容密闭容器中发生反应: A(s) +2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A. ②③⑤ B. ①②③ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com