
科目: 来源: 题型:
【题目】工业废水中常含有酚类、重金属、氰类、三氯甲烷及砷类等有害物质,必须处理后才可排放。
(1)用FeS除去废水中重金属汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
(2)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是___________。
②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为___________(不考虑副反应)。
③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为___________。
(3)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:

纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为___________;在含高浓度SO42-的酸性溶液中脱除砷的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 离子半径:X<Y<Z<W
D. 含W的盐溶液可能呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铅蓄电池的工作原理为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的________极,Cu电极是________极,放电过程中电解液的密度________(填“减小”“增大”或“不变”)。
(2)Ag电极的电极反应式是______________________________,该电极的电极产物共________g。
(3)Cu电极的电极反应式是______________________________,CuSO4溶液的浓度________(填“减小”“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1mol H2SO4中含________个硫原子,__________个氢原子,___________mol氧原子。
(2)2molCO与3molCO2的质量之比________;分子数之比为_______ ;含氧原子的数目之比为______。
(3)用20g NaOH配制成500mL溶液,其物质的量浓度为____________mol/L,从中取出1mL,其物质的量浓度为___________mol/L,含溶质_____________g。若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为___________mol/L。
(4)500mL质量分数为50%的硫酸溶液中 密度为1.568g/cm3,则溶液的物质的量浓度为________mol/L 。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水.这些叙述中正确的是( )
A.①②③④B.②③C.①②④D.②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
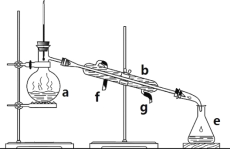
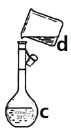
I II
(1)写出下列仪器的名称:a.____________;b. ___________;c. ___________。
(2)仪器c使用前必须__________________。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在______________________处。冷凝水由_____(填f或g)口通入______口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。①图中的错误是____________。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:_____________。②根据计算得知,所需NaOH的质量为_______g。③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(5)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为_______________________________;
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度线_______________;若定容时俯视刻度线________;若配制完成后发现砝码和药品颠倒了,则结果______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________________ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() )________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
)________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是__________(填写字母),导致pH随温度变化的原因是___________________________________________;
②20℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )c(
)c(![]() )3c(Al3+)=_________(填数值)。
)3c(Al3+)=_________(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若电路中通过2 mol电子,则电池内部释放632 kJ热能
D. 若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
查看答案和解析>>
科目: 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

请根据混合物分离或提纯原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ___________;(2)用自来水制取蒸馏水 ___________;(3)分离植物油和水 ___________;(4)与海水晒盐原理相符的是 ___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com