
科目: 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目: 来源: 题型:
【题目】尼泊金乙酯是一种高效食品防腐剂,被广泛应用于酱油、醋等调味品、烘焙食品以及果蔬保鲜等领域。下图是以苯等为原料合成尼泊金乙酯的合成路线:
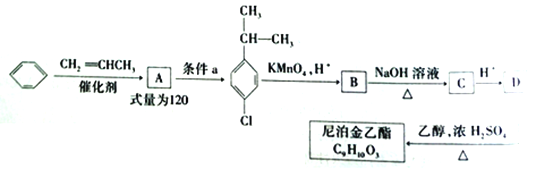
已知: 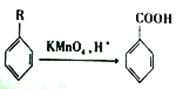 (R为烃基)
(R为烃基)
请回答有关问题:
(1)由苯生成A的反应类型是______,条件a指的是_____,化合物D中所含官能团的名称为____________。
(2)写出B→C 的化学方程式________________。
(3)尼泊金乙酯的结构简式为_________。
(4)化合物D的同分异构体中含有苯环且能发生银镜反应的有______种,其中核磁共振氢谱有4组峰的同分异构体的结构简式为_________(任写两种)。
(5)若以苯为原料( 其它原料自选)合成装苯甲酸甲酯,參照上述流程设计写出合成路线。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某种由KCl、NaCl组成的混合物中,钾、钠离子的物质的量之比是1:2,则此混合物中,KCl的质量分数是___________.如果该混合物中含6molCl-,那么,此混合物中有NaCl__________g.
查看答案和解析>>
科目: 来源: 题型:
【题目】蒽的结构简式如右图(![]() )、联苯的结构简式如右图(
)、联苯的结构简式如右图(![]() ),下列 有关蒽和联苯的说法中正确的是( )
),下列 有关蒽和联苯的说法中正确的是( )
A. 联苯和蒽同属于芳香烃,两者互为同系物
B. 联苯的一氯代物有 3 种,蒽的二氯代物有 15 种
C. 1mol 蒽最多可以和 9molH2 发生加成反应
D. 联苯易发生加成反应、取代反应,也易溶于水
查看答案和解析>>
科目: 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。宝鸡因钛产业发达被称为中国钛谷,其钛产品产量占全国80%以上,占世界产量的20%以上。请回答下列问题:
(1)钛元素位于周期表中第4周期_____族,基态铁原子的价电子的电子排布式为______。
(2)钛元素在化合物中有+2、+3、+4等多种价态,试分析因显著的“压电效应“面被广泛应用于超声波发生装置中的偏钛酸钡(BaTiO3)中Ti的化合价为______。
(3)TiCl3是一种不稳定的氯化物,主要用作强还原制、烯烃聚合的催化剂以及偶氮染料分析等。
①溶波中的Ti3+易被FeCl3氧化,发生反应的离子方程式为________;若利用此反应原理,用已知标准浓度FeCl3溶液来滴定某含Ti3+的溶液时,可选用______溶液作指示剂判断滴定的终点。
②化学式为[Ti(H2O)6]Cl3的绿色晶体是TCl3的六水合物的一种晶型,该晶体中,与Ti3+T形成配位键的原子是_____(填元素符号),该原子的杂化类型为________;该晶体所含元素中,电负性最大的元素是_______(写出元素符号)。
③化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol绿色晶体溶于水配成500mL溶液,加入足量AgNO3使Cl-完全沉淀,消耗AgNO3的物质的量为____mol。
④写出一种与H2O互为等电子体的阳离子______(填化学式)。
(4)TiO2的熔点为1800℃,TiCl4的熔点为-25℃,同为Ti的+4价化合物,熔点相差悬殊的原因是___________。
(5)自然界的钛主要以金红石( 主要成分为TiO2)的形式存在。TiO2 的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2 的摩尔质量为M g/mol,阿伏加德罗常数的值为NA,根据图中所示数据列出该晶体密度的计算式ρ=_______g·cm-3(用NA表示阿伏伽德罗常数,用含M、a、b、c的代数式表示)。
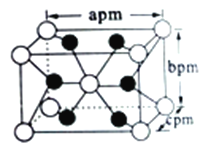
查看答案和解析>>
科目: 来源: 题型:
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4H2O。
(1)Cu2+价电子排布式为_______;[Cu(NH3)4]SO4H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为_____。
(2)SO42-中S原子轨道杂化类型为_____,H2O与H+以配位键形成H3O+,则H3O+的空间构型为____(用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为___________。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________。
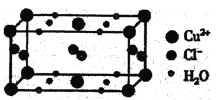
查看答案和解析>>
科目: 来源: 题型:
【题目】为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)=![]() N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g)![]() SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。

(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如下。
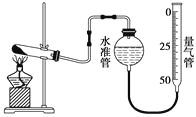
部分实验步骤:
①装好实验装置。
② 。
③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为m g。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热。
⑥测量收集到的气体体积。
⑦准确称量试管和残留物的质量为n g。
⑧测量实验室的温度。
回答下列问题。
(1)实验步骤的第②步是 ________________________________________________。
(2)测量收集到的气体体积,应注意的事项有:
①_____________________________________________________________________;
②_____________________________________________________________________;
③视线与凹液面最低处相平。
(3)如果实验中得到的氧气体积是p L,水蒸气的影响忽略不计,则室温下气体摩尔体积的计算式为__________(含m、n、p)。
(4)假定其他操作均正确,未恢复至室温就读数会导致实验结果___________________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com