
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si元素非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)写出甲选用物质的名称:A____________,B__________,C____________;
(2)写出乙同学的实验B处的离子方程式: ___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I、有4种化合物W(通常状况下是气态)、X(通常状况下是液态)、Y、Z(通常状况下是固态),它们共由5种短周期元素A、B、C、D、E组成。已知:①原子序数A<B<C<D<E,且A与D同族;C与E同族;B与C同周期。②W由A和B组成,且W分子中,A与B的原子个数比为4∶1;X由A和C组成,且X分子中A与C的原子个数比为1∶1;Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1∶1。③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2∶1。试推断写出:
(1)W的化学式是________,W属于________化合物。
(2)X的电子式是________,X属于________化合物。
(3)1 mol Y在干燥的空气中质量会______(填“增大”或“减小”),其变化量(Δm)为________。
(4)用电子式表示化合物Z的形成过程________。
II.已知Si—Cl键、H—H键、H—Cl键、Si—Si键的键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、d kJ·mol-1,1 mol硅晶体含2 mol Si—Si键。工业上,提纯硅的化学方程式是SiCl4(g)+2H2(g)===Si(s)+4HCl(g) 则该反应的反应热是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列四种物质,①NA个HCl ②24gCH4 ③4.816×1023个H2O2分子 ④10.8mL水(密度为1g·cm-3)。
ⅰ.四种物质所含分子数由多到少的顺序是:_________________________________;
ⅱ.四种物质所含原子数由多到少的顺序是:_________________________________;
ⅲ.四种物质所含H由多到少的顺序是:_____________________________________;
ⅳ.四种物质的质量由多到少的顺序是:_____________________________________。
(2)H2O与CO2的质量比为18:22,则H2O和CO2的物质的量之比为________,分子个数比为_______,原子个数比为__________,所含氧原子个数比为___________。
(3)在标准状况下,等质量的O3和CO2比较,密度比为________,分子数之比为_________,原子数之比______,体积比为_______,物质的量之比__________。
(4)CH4与H2的混合气体,其质量百分含量分别为80%、20%,则混合气体的平均相对分子质量为__________。
(5)标准状况下,某气体密度为1.96g/L,则该气体的摩尔质量为_____(保留整数)
(6)把100克某NaOH溶液(密度是1.22g/cm3)蒸发浓缩,余下溶液50ml时,物质的量浓度是8mol/L,原溶液的物质的量浓度是 _________________。
(7)已知Na2S、Na2SO3、Na2SO4混合物中硫元素的质量分数为a%,则氧元素的质量分数为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】非典型肺炎是由病毒感染引起的。不少群众购买醋精用于室内消毒灭菌,这是因为醋精( )
A. 沸点低 B. 能使蛋白质变性
C. 有酸性 D. 具有医疗保健作用
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
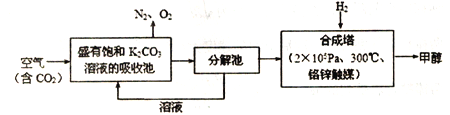
(1) 已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-94.9kJ/mol
CH3OH(g) ΔH1=-94.9kJ/mol
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
则在合成塔中,CO2与H2反应生成气态的H2O和甲醇的热化学方程式为_________.
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”( 写出一条即可)________.
(3)一定条件下,往2L 恒容密闭容器中充入1mol CO2 和3 mol H2,在不同催化剂作用下发生反应I、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如下图所示:

①催化剂效果最佳的反应是__________(填“反应I”,“反应Ⅱ”,“反应Ⅲ”)。
②b点v (正)______ v (逆)(填“>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
④c点时该反应的平衡常数K =________。
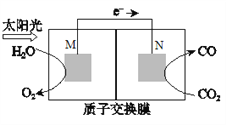
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为__________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5mo/L,则生成沉淀所 需CaCl2溶液的最小浓度为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO![]() 的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
的物质的量浓度为3 mol·L-1,则此溶液最多溶解铁粉的质量为( )信息:Fe2(SO4)3+Fe=3FeSO4
A. 5.6 g B. 11.2 g C. 22.4 g D. 33.6 g
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:

资料a: Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH见下表(金属离子的起始浓度为0.1 mol·L-1)
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是__________________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入黄色K3[Fe(CN)6](铁氰化钾)溶液,无明显变化:另取少量滤液1于试管中,___________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:i.2Fe2++Cl2=2Fe3++2Cl-
ii.4Fe2++O2+4H+=4Fe3++2H2O iii.……
写出iii的离子方程式:___________________________。
(2)过程II的目的是除铁,有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ii.焙烧法:将滤液1浓缩得到的固体于290°C焙烧,冷却,取焙烧物……
己知:焙烧中发生的主要反应2FeCl3+3O2=2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在 _______________之间。
②补全ii中的操作:____________________。
③两种方法比较,氨水法除铁的缺点是_________________________________________。
(3)过程III的目的是除铅。加入的试剂是______________________。
(4)过程IV所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com