
科目: 来源: 题型:
【题目】某实验小组利用FeS处理含Cu2+和Pb2+废水后的废弃固体(主要成分CuS、FeS、PbS、SiO2)制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:

(1)提高步骤①反应速率的措施,除温度外,还有_____________(写一条);
(2)处理废水时,FeS与Pb2+反应的离子方程式为____________;
(3)固体A的主要成分是_______________(填化学式);
(4)步骤⑤中,所加试剂x为____________(填标号);
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是_________________________;
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为____________;
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=______mol·L-1(忽略体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2﹣氨基﹣3﹣氯苯甲酸(H)是重要的医药中间体,可以用来合成许多重要有机物,其制备流程图如下:

已知: 
回答下列问题:
(1)反应①的反应类型是________。
(2)写出反应②的化学反应方程式________。
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,目的是__________。
(4)E的结构简式为_______,对比D与H的结构简式,设计⑥~⑨四步反应实现转化的目的是_______。
(5)写出⑧的反应试剂和条件:_____。
(6)J是一种高分子化合物,写出反应⑩的化学反应方程式:_____。
(7)写出符合下列条件的B的所有同分异构体的结构简式__________。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请从Cl2、H2、CO2、NO、NH3气体中选择一种气体,该气体在实验室可以用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学反应方程式为_____________;

(2)已知:
可用下述装置制取1,2 - 二溴乙烷(无色液体,密度2.18 g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是____________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是______________;
③实验结束后,要精制试管d中的粗产品,操作先后顺序是______(填标号)
A.蒸镏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗 E.水洗
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2 - 二溴乙烷的产率为_____________(用含M,m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有Cl-、PO43-,简述实验方案。已知:氯化银、磷酸银(黄色)、磷酸钡(白色)的KSP分别为1.77×10-10、8.88×10-17 和3.4×10-23。
答:_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有如下三个热化学方程式:
H2(g)+1/2O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述正确的是( )
A. 它们都是吸热反应 B. a、b和c均为正值
C. 2b=c D. a=b
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: 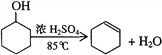
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
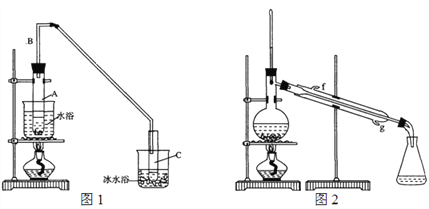
(1)制备粗品:采用如图1所示装置,用环己醇制备环己烯。
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B的作用是_______________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用________洗涤(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从____口(填字母)进入。蒸馏时加入生石灰,目的是______________________________________。
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母)。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高锰酸钾溶液
b. 用金属钠
c. 测定沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应式为2CH2===CH2+O2===2CH3CHO。下列有关说法正确的是
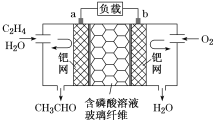
A. 每有0.1 mol O2反应,则迁移H+0.4 mol
B. 负极反应式为CH2===CH2-2e-+H2O===CH3CHO+2H+
C. 电子移动方向:电极a→磷酸溶液→电极b
D. 该电池为二次电池
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是

A. 当a、b都是铜作电极时,电解的总反应方程式为2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
C. 当燃料电池消耗22.4 L甲醛气体时,电路中理论上转移2 mol e-
D. 燃料电池工作时,负极反应为HCHO+H2O-2e-===HCOOH+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下。下列说法不正确的是

A. 电解器中阳极的电极反应式为2Cl--2e-===Cl2↑
B. 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g
C. 解汞室中产生氢气的电极为阴极
D. 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式中ΔH表示可燃物燃烧热的是
A. CO(g)+1/2O2(g)===CO2(g) ΔH=-283 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol-1
CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol-1
②催化液化Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
③催化液化Ⅱ:CO2(g)+2H2(g)![]() CH3OH(g)+1/2O2(g) ΔH3=a kJ·mol-1
CH3OH(g)+1/2O2(g) ΔH3=a kJ·mol-1

A. 催化液化Ⅰ中使用催化剂,反应的活化能Ea、ΔH2都减小
B. 反应C(s)+H2O(g)+H2(g)![]() CH3OH(g) ΔH=+41.1 kJ·mol-1
CH3OH(g) ΔH=+41.1 kJ·mol-1
C. ΔH2>ΔH3
D. 如图为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e-+6OH-![]() CO2↑+5H2O
CO2↑+5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com