
科目: 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。

请回答下列问题:
(1)上述脱硫过程实现了________(填字母)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
D.获得金属单质
(2)已知:25 ℃、101 kPa时, Mn(s)+O2(g)===MnO2(s)ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是_____________________。
(3)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如图所示。

①a应与直流电源的________(填“正”或“负”)极相连。
②电解过程中氢离子的作用是____________________________;
③阳极的电极反应反应方程式为:______________若转移的电子数为6.02×1023,左室溶液中n(H+)的变化量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是

A. 脱氧曲酸的分子式为C6H4O3
B. 脱氧曲酸能发生加成反应和酯化反应
C. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
D. 与脱氧曲酸互为同分异构体的芳香族化合物有3种(不考虑—O—O—键)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中I是一种高分子化合物,其合成路线如图:


已知:①![]()
②回答下列问题:
(1)A的名称为_______(系统命名法),G含有的官能团_____(写名称)。
(2)反应①的反应类型是________.
(3)I的结构简式为_____________________________;
(4)反应②的化学方程式为__________________________________。
(5)符合下列条件的G的同分异构体共有___________种。
①与G具有相同官能团; ②属于芳香族化合物
(6)参照上述合成路线,设计一条由乙醛、甲醇和J(E的同系物且相对分子质量比E小14)为主要原料(无机试剂任选)制备![]() 的合成路线______________。
的合成路线______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I、有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中,写出具有以下性质的物质的结构简式:
(1)能使石蕊试液变色的有______种.
(2)催化氧化后产物能与新制氢氧化铜发生氧化还原反应的是______
(3)不同情况下与氢氧化钠反应能生成两种盐的是______.
II、有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为:________. |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为:________. |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况). | (3)用结构简式表示A中含有的官能团:________、________. |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子. |
(5)综上所述,A的结构简式________. | |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式中,不正确的是( )
A.HCl═H++Cl﹣
B.NH3H2O═NH4++OH﹣
C.CaCl2=Ca2++2Cl﹣
D.CH3COOHCH3COO﹣+H+
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)VO43-的中心原子价层孤电子对数目为______,一个VO43-离子中含有_______个σ键;
(3)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
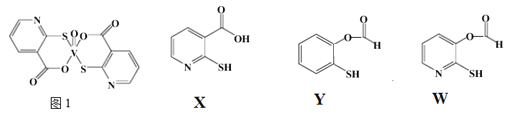
①该药物中N原子的杂化方式是_______;
②X、Y、W三种物质在水中的溶解性由大到小的顺序为________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]()
![]() 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]()
![]() 。
。
③下列微粒中存在“离域Π键”的是_____;
A.O3 B.SO42- C.H2S D.NO3-
④CS2分子中大π键可以表示为_______________;
(4)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(5)某六方硫钒化合物晶体的晶胞如图4所示(![]() 表示V,
表示V,![]() 表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
表示S),该晶胞的化学式为VS。图3 为该晶胞的俯视图。
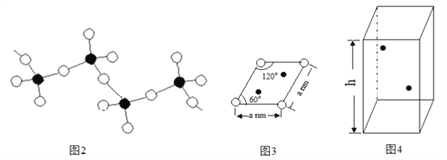
①请在图4中用![]() 标出V原子的位置;
标出V原子的位置;
②已知晶胞的密度为dg/cm3 ,计算晶胞参数h =_____________cm。(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】用石墨电极完成下列电解实验。下列对实验现象的解释或推测不合理的是
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
A. a、d处:2H2O+2e-=H2↑+2OH-
B. b处:2Cl--2e-=Cl2↑,Cl2溶于水生成HClO,使溶液褪色
C. c处发生了反应:Fe-2e-=Fe2+
D. 根据实验一的原理,实验二中n处能析出O2
查看答案和解析>>
科目: 来源: 题型:
【题目】I 有一种有机物X,其结构简式为:HO—CH2CH=CH—COOH,试回答下列问题:
(1)X中的含氧官能团名称是_______________、_______________。
(2)向X中加入金属钠,将发生反应的化学方程式是_______________。
(3)如果在X中加入NaOH溶液,将发生反应的化学方程式是___________。
(4)下列关于X的说法中正确的是________________。
①X既能与酸发生酯化反应,又能与醇发生酯化反应
②X能够使溴水褪色,但不能使KMnO4酸性溶液褪色
③X能够发生缩聚反应,但不能发生加聚反应
II.分子式为C3H6O2的有机物有多种同分异构体,现有其中的四种X、Y、Z、W,它们的分子中均含甲基,将它们分别进行下列实验以鉴别,其实验记录如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
W | 水解反应 | 无现象 | 无现象 | 无现象 |
回答下列问题:
(1)写出X的结构简式________, W的系统命名是________.
(2)①Y在一定条件下发生分子内的脱水反应的化学方程式________________
②Z与NaOH溶液反应的化学方程式_______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有一种变化的反应类型与其他三种变化不同的是( )
A. CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B. CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C. 2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D. CH3CH2OH + HBr=CH3CH2Br + H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔(CH≡CH)是重要的化工原料,广泛应用于焊割、燃料电池及有机合成等。
(1)乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为_____________;
(2)科学家利用“组合转化技术”,将乙炔燃烧产物CO2转化成乙烯,反应式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)
CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)
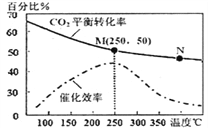
①250℃时,催化剂的催化效率最大
②随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)甲烷裂解法制取乙炔的反应方程式为:2CH4(g)![]() C2H2(g)+3H2(g)。已知:
C2H2(g)+3H2(g)。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ·mol-1
C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2= b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3= c kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) △H=______kJ·mol-1
C2H2(g)+3H2(g) △H=______kJ·mol-1
(4)哈斯特研究发现:甲烷裂解时,几种气体平衡时分压(Pa)与温度(℃)之间的关系如图所示。甲烷裂解可能发生的反应有:2CH4(g)![]() C2H2(g)+3H2(g),2CH4(g)
C2H2(g)+3H2(g),2CH4(g)![]() C2H4(g)+2H2(g)。
C2H4(g)+2H2(g)。
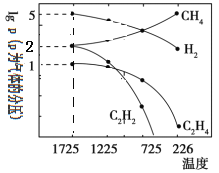
①1725℃时,向1L恒容密闭容器中充入0.3molCH4,达到平衡时,测得c(C2H2)=c(CH4)。则CH4生成C2H2的平衡转化率为_______;
②1725℃时,反应2CH4(g)![]() C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com