
科目: 来源: 题型:
【题目】下列有关金属晶体的说法中,正确的是( )
A. 简单立方堆积的晶胞中原子配位数是8
B. 晶胞中配位数为12的金属,一定是面心立方最密堆积
C. Zn的晶胞类型与铜相同
D. 铁的晶胞中空间利用率为68%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学实验操作中“先”与“后”的说法错误的是
A.用排水法收集气体后,先移出导管后撤酒精灯
B.给试管加热时,先均匀加热,后局部加热
C.配制硫酸溶液时,可先在烧杯中加入一定量的水,再在搅拌条件下加入浓硫酸
D.做“氢气还原氧化铜”实验时,先加热再通氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是( )。
A. C2H2C2H6 B. CH4C3H8 C. C3H6C3H8 D. C2H4C4H8
查看答案和解析>>
科目: 来源: 题型:
【题目】(在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO3- | CO32- | SiO32- | SO42- |
现取该溶液100mL进行如下实验(气体体积在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 生成白色胶状沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ中产生的混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是________;
(2)实验Ⅰ中生成气体的离子方程式为________;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)_____。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c(mol/L) | 0.25mol/L |
(4)判断K+是否存在,若存在,其最小浓度为________,若不存在,请说明理由:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑
B.氢氧化钠与盐酸反应:OH﹣+H+═H2O
C.锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu
D.氯化钡溶液与稀硫酸反应:Ba2++SO42﹣═BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)混合气体中碳原子的个数________。(用NA表示阿伏加德罗常数的值)
(2)该混合气体的平均摩尔质量________g/mol。
(3)将混合气体依次通过如图装置,最后收集在气球中。气球中收集到的气体是________,标准状况下气球中收集到的气体的体积为________L,如果上述装置中使用的浓硫酸失效,则气球中气体的相对分子质量会________(填“变大”、“变小”或“不受影响”)。
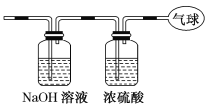
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验室需要480mL,0.5mol/L的稀硫酸,现欲用98%的浓硫酸(ρ=1.84g/cm3 )配制,配制步骤包括:①计算所用浓硫酸的体积②转移③定容、上下颠倒摇匀④量取一定体积的浓硫酸⑤洗涤并转移⑥稀释并冷却至室温⑦轻摇混匀。完成下列问题:
(1)正确的操作顺序为(填入序号)________。选用的主要仪器有:量筒、烧杯、玻璃棒、________、________。
(2)应量取浓硫酸的体积为________;量取浓硫酸所用的量筒的规格是________(从下列中选用,填字母 A.10 mL B.25 mL C.50 mL D.100 mL);第⑥步中稀释实验的操作方法是________。
(3)下列关于容量瓶的使用方法中,正确的是________。
A.使用前要检验是否漏水
B.在容量瓶中直接溶解固体或稀释液体
C.溶液未经冷却即注入容量瓶中
D.向容量瓶中转移溶液要用玻璃棒引流
(4)下列情况中,所配制的稀硫酸浓度偏大的是________。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.用量筒量取浓硫酸时仰视刻度
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某学习小组做Na2O2与H2O反应的实验,发现一些有趣的现象:
①取适量Na2O2固体用脱脂棉包好放在石棉网上,然后向脱脂棉上滴加3-4滴水,结果脱脂棉剧烈燃烧。
②取适量Na2O2固体置于试管中,加水使其充分反应至不再产生气体为止,滴入几滴酚酞试液,溶液先变红后褪色。回答有关问题。
(1)写出Na2O2的电子式_______________________。
(2)已知Na2O2可看作二元弱酸H2O2对应的盐,其第一步水解完全进行。写出其第一步水解的离子方程式为___________________________________。
(3)由①实验现象所得出的有关结论是:a.有氧气生成;b.___________________。
(4)Na2O2与H2O反应的离子方程式____________________________________。
II.为探究Na2O2与H2O反应的机理,他们在老师的指导下设计了下图所示装置。连接好装置,打开K1、K2,通过注射器注入适量蒸馏水,充分反应后用气球鼓气,Na2S溶液变浑浊,酸性KMnO4溶液褪色。分别取A、C中溶液滴入几滴酚酞,开始都变红,以后A中溶液很快褪色,C中溶液缓慢褪色。另取A、C中溶液分别加入少量二氧化锰,充分振荡,发现均反应剧烈、产生大量气泡,把带火星的木条伸入试管,木条复燃,向反应后的溶液中滴入几滴酚酞试液,溶液变红不褪色。
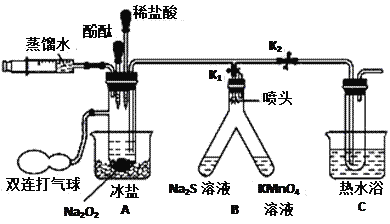
(5)A中冰盐和C中热水的作用分别是__________________,___________________。
(6)用化学方程式表示Na2S变浑浊的原因___________________________________。
(7)用离子方程式表示KMnO4溶液褪色的原因(MnO4-在酸性条件下被还原成Mn2+)__________________________________________。
(8)Na2O2与H2O反应的机理是(用化学方程式表示)第一步_____________________,第二步_______________________________。
(9)若向Na2O2中滴加适量的稀盐酸,也能产生同样的气体,请写出该反应的化学方程式___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )
N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )

A. N4属于一种新型的化合物 B. N4分子中存在非极性键
C. N4和N2是同分异构体 D. 1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应:4P+3KOH+3H2O===3KH2PO2+PH3,已知PH3的P的化合价为-3,磷单质在反应中
A.被氧化B.被还原
C.既被氧化又被还原D.既未被氧化又未被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com