
科目: 来源: 题型:
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。

已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38
请回答下列问题:
(1)写出氯化钡的电子式________。盐酸和硫化钡反应的化学方程式为________。
(2)吸收液X的溶质是________。一定条件下向(NH4)2S溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为________。
(3)操作1的名称是________,操作3的过程是将容液B蒸发浓缩、________、过滤等。
(4)沉淀D的成分是________。
(5)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________。
(6)室温时,若加碱调溶液pH至9,则完全沉淀的离子是________ 。
(7)此工艺流程中循环利用的物质是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
B.钠可以从AgNO3溶液中置换出金属银
C.钠能与水反应,所以钠着火不能用水灭火,要用泡沫灭火器
D.Na2O、Na2O2、NaOH和NaHCO3均是强电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
①已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动(填“向左”“向右”或“不”)。

(2)在相同温度下,两个体积均为1L的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编号 | 起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 | |
I | 0.2 | 0.2 | 0 | 0 | a |
II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO催化转化进行研究。测得NO转化为N2的转化率随温度CO混存量的变化情况如图所示。
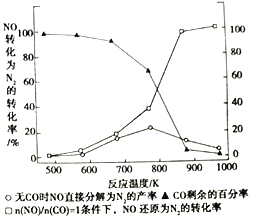
①在n(NO)/n(CO)=1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2的转化率增大的原因是_______ (用平衡移动的原理解释)。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.甲烷能与氯水发生取代反应
B.苯分子中无碳碳双键,苯不能发生加成反应
C.乙烯和苯均能与溴水反应而使其褪色
D.乙酸是一种弱酸,但其酸性比碳酸强
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生产生活及科研中应用广泛。
(1)聚合硫酸铁的化学式为[![]() ]m,是常用的水处理剂。基态铁原子的核外电子排布式为___________,聚合硫酸铁中铁元素阳离子有_________个未成对电子。
]m,是常用的水处理剂。基态铁原子的核外电子排布式为___________,聚合硫酸铁中铁元素阳离子有_________个未成对电子。
(2)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为_______,1mol [Fe(CN)6]3-离子中含有σ键的数目为__________。
②已知N3-与CS2为等电子体,则N3-的空间构型为_________。
(3)氟化亚铁晶胞属于四方晶系,其长方体结构如图所示,根据图中所示数据计算该晶体密度ρ=_________g·cm-3。(列出计算式即可)(1pm=10-12m)
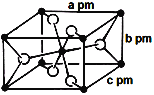
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。实验室用如图所示装置制备亚硝酸钠。请回答下列问题:

已知:①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
(1)仪器a的名称是_____________。
(2)B装置中的主要现象是_______。C中的试剂可以是____________。
(3)D中反应生成NaNO2的化学方程式为_______。E装置的作用是______________。
(4)检验D装置中生成NaNO2
操作 | 现象 | 结论 |
_____________ | ____________ | 有NaNO2生成 |
(5) NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉中提取NaNO2后,配成溶液,再用0.0050mol/L的酸性高锰酸钾溶液滴定,滴定起始和终点的液面位置如图所示,计算隔夜熟肉中NaNO2的含量是_______mg/kg。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是
A. 明矾能水解生成Al(OH)3胶体,可用作净水剂
B. 除去MgCl2酸性溶液中的Fe3+,可加入MgCO3固体
C. SO2具有氧化性,可用于漂白纸浆
D. Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol/LNa2CO3溶液1L所含阴离子数目小于0.1NA
B. 常温常压下,3.2gCH4中含有的电子数为2NA
C. 1molCl2溶于足量的水中,反应时斯裂的Cl-Cl键数目为NA
D. 标准状况下,11.2LCH3CH2OH中含有的分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com