
科目: 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目: 来源: 题型:
【题目】
AlN 氮化铝是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素。回答下列问题:
(1)As基态原子的电子占据了______个能层,最高能级的电子排布式为______。和As位于同一周期,且未成对电子数也相同的元素还有______种。
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是______ (填元案符号)。Si、P、S三种元素的 第一电离能由大到小的顺序是______。
(3)NH3、PH3、AsH3三者的沸点由高到低的顺序是______。原因是______。
(4)白磷是由P4分子形成的分子晶体,P4分子呈正四面体结构,P原子位于正四面体的四个顶点,则P原子的杂化形式为_____,白磷易溶于CS2,难溶于水,原因是__________________。
(5)采用GaxIn1-xAs(镓铟砷)等材料,可提高太阳能电池的效率。GaxIn1-xAs立方体形晶胞中每个顶点和面心都有一个原子,晶胞内部有4 个原子,则该晶胞中含有_________个砷原子。
(6)AlN晶体的晶胞结构与金刚石相似(见下图),设晶胞的边长为ɑ pm,NA表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3。
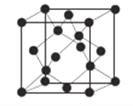
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH3)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-159.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________。
(2)工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如右图所示:
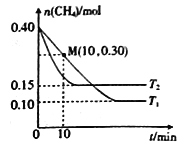
①根据右图判断该反应的△H________0(填“>”、“<”或“=”),理由是______________。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=___(保留三位小数)
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.升高温度
C.缩小容器的体积 D.增加CH4的浓度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________;常温下,将amol·L-1 的HN3与bmol·L-1 的Ba(OH) 2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该混合物溶液呈_______(填“酸”、“碱”或“中”)性,溶液中c(HN3)=_________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出E元素名称:________
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,BC分子的结构式是 ________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是______________。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的价电子排布式是________,在元素周期表中位置是______________,其最高价氧化物的化学式是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于镍粉的制造,其中一种生产工艺如下(已知还原性:Fe2+>Ni2+):
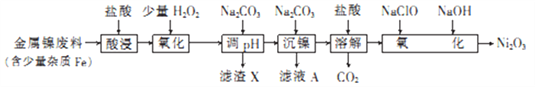
回答下列问题:
(1) Ni2O3中Ni 的化合价为________________。
(2)为了提高金属镍废料浸出速率,在“酸浸”时可采取的措施有_______________________(写两条)。
(3)若将H2O2溶液改为酸性KMnO4溶液(在该实验条件下,Ni2+不能被KMnO4氧化),则“氧化”过程中的离子方程式为_______________________;加入Na2CO3溶液调pH,产生的“滤渣X”是_____________。
(4)从滤液A中可回收利用的主要物质是___________________;加入NaClO溶液和NaOH溶液,“氧化”生成Ni2O3的离子方程式为_________________________。
(5)工业上用镍为阳极,电解0.05~0.1mol·L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl 的浓度对阴极电流效率及镍的成粉率的影响如下图所示:
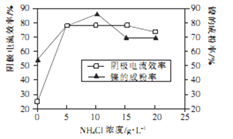
①NH4Cl浓度最好控制为____________g·L-1。
②当NH4Cl浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,相应的电极反应式
为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,11.2 LH2和14gN2所含原子数相同;
③28gCO 的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ⑤⑥ B. ②③⑤⑥ C. ②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/L的NaOH溶液,所得溶液pH与NaOH溶液体积的关系曲线如图所示,下列说法正确的是

A. a、b、c、d四个点中,水的电离程度最大的是d
B. 常温下,NH3·H2O的电离平衡常数Kb=5×10-6
C. b点溶液中:c(Na+)+c(NH4+)=c(SO42—)
D. c点溶液中:3c(Na+)= 4[c(SO42—) +c(NH4+)+ c(NH3·H2O)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com