
科目: 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)基态Ti 原子的价层电子排布图为________________________。
(2)在TiO、TiN、TiS2、TiCl4等化合物中,S、Cl的电负性大小:S________Cl (填“>”、“<”或“=”)。O、N 的第一电离能大小为O < N,原因是___________________________。
(3)TiCl4的熔点是-23℃,沸点是136℃,可溶于CCl4,该晶体是_______ 晶体。TiCl4中加入大量水,同时加热,可制得二氧化钛的水合物(TiO2·xH2O),再经焙烧可得TiO2,写出生
成二氧化钛水合物(TiO2·xH2O)的化学方程式_________________________________。
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图1所示,其化学式为_____________。阴离子SO42-中硫原子的杂化方式为______________,写出一种与SO42-互为等电子体的分子_____________。
(5)下图2是钛晶体在空间的一种堆积方式,此堆积方式叫______________,钛原子的配位数为____________。已知:a=0.295 nm,c=0.469nm,则该钛晶体的密度为_________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是危害最为严重的大气污染物之一,它主要来自化石燃料的燃烧,研究CO催化还原SO2的适宜条件,在燃煤电厂的烟气脱硫中具有重要价值。
Ⅰ.从热力学角度研究反应
(1)C(s)+O2(g)= CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
S(s) +O2(g)= SO2(g) ΔH3=-296.0kJ·mol-1
请写出CO 还原SO2的热化学方程式___________________________________。
(2)对于CO还原SO2的可逆反应,下列说法正确的是_____________。
A.在恒温恒容条件下,若反应体系压强不变,则反应已达到平衡状态
B.平衡状态时,2v正(CO)=v逆(SO2)
C.其他条件不变,增加SO2的浓度,CO的平衡转化率增大
D.在恒温恒压的容器中,向达到平衡状态的体系中充入N2,SO2的平衡转化率不变
Ⅱ.探究合适的反应条件
向反应器中通入含3%SO2、6%CO和91%N2的烟气,用碘量法测定反应前后烟气中SO2的含量,反应温度区间均为300℃~500℃。
(1)催化剂和温度对反应的影响
烟气流量为0.03 L/min,分别在3种不同催化剂条件下进行实验,实验结果如下图所示。

根据上图示结果,烟气除硫时选用最合适催化剂是_____________,反应温度是_______________。
(2)烟气流速对反应的影响
选用同样的催化剂,分别在三种烟气流量情况下进行实验,实验结果的数据见下表。
温度(℃) | 300 | 400 | 500 | |
SO2转化率 | 流量0.03 L/min | 25.00% | 71.40% | 65.00% |
流量 0.06 L/min | 20% | 74.20% | 62.60% | |
流量0.09 L/min | 18% | 76.30% | 60% | |
分析上表数据,①在300℃时,SO2的转化率随烟气流量变化的关系是______________,其原因可能是____________;②在400℃时,SO2的转化率随烟气流量增大而增大的原因是___________________。
Ⅲ.工业上还用Na2SO3溶液吸收SO2,将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6 时,吸收SO2的能力显著下降,此时溶液中c(HSO3-)∶(SO32-)=____________。(已知H2SO3的K1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室要配制480mL 0.2mol·L-1的NaOH溶液:请结合实验回答下列问题:
(1)实验中需称量NaOH固体的质量为__________
(2)实验步骤主要有计算、称量、溶解、转移和定容。
①完成上述实验步骤要用到的玻璃仪器有烧杯、量筒、玻璃棒、__________。
②溶解和转移过程中玻璃棒的作用分别是__________和__________。
(3)分析下列操作对所配制溶液浓度的影响(填 “偏高”“偏低”或“无影响”)。
①转移液体过程中有少量液体溅出:__________;
②定容时仰视刻度线:__________;
③容量瓶洗净后,未经干燥处理:__________;
④将NaOH固体溶解后,直接转至容量瓶中进行实验:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:

已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是

A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】正在研发的锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如图。下列有关该电池的说法正确的是

A. 有机电解液可以换成水性电解液
B. 放电时,外电路通过2 mol 电子,消耗氧气11.2 L
C. 放电和充电时,Li+迁移方向相同
D. 电池充电时,在正极上发生的反应为4OH--4e-= O2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是SO2制取、性质检验、收集、尾气处理的装置,有关说法正确的是

A. 上图中有两处错误
B. 装置①也可以用于制取氨气、氯气
C. 在②中加入品红或紫色石蕊试液都可以验证SO2的漂白性
D. 在②中加入BaCl2溶液,先生成白色沉淀,随后沉淀慢慢消失
查看答案和解析>>
科目: 来源: 题型:
【题目】A是常见的有机物质,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示,请回答下列问题:
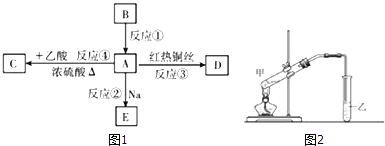
(1)B的结构式为___ . D的物质的名称是___ .
(2)在①~④反应中,属于加成反应的是___(填反应序号).
(3)写出下列反应的化学方程式:
反应①___;反应②___;反应③___ .
(4)实验室用如图2所示装置进行反应④.
a.反应④的化学方程式是___ .
b.试管乙中应加入___,乙中的导管不能伸入到液面下的原因是___ .
c.实验完成后,从试管乙中分离出有机物C的方法是___ .
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。回答下列问题:
(1)0.3mol NH3分子中所含原子数与__________个H2O分子中所含原子数相等。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是__________
(3)—定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为__________
(4)某混合盐溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO42-) =__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于实验室制取氨气的说法不正确的是( )
A.可用浓盐酸检验氨气
B.可用浓硫酸干燥氨气
C.可用向下排空气法收集氨气
D.可将浓氨水滴入盛有生石灰的烧瓶制取氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com